Гидролиз. Применение гидролиза. (11 класс) презентация
Содержание
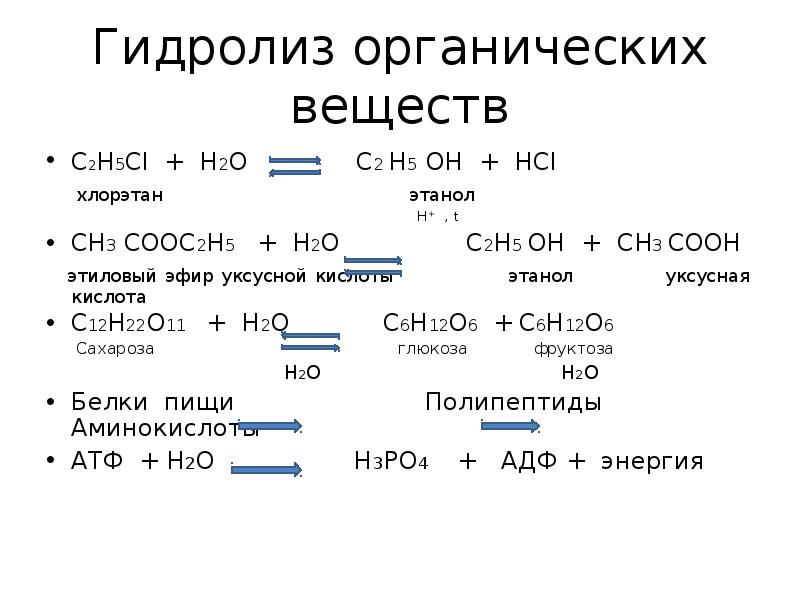
- 3. Гидролиз органических веществ C2H5Cl + H2O C2 H5
- 4. Гидролиз бинарных соединений Карбиды металлов: CaC2 + 2H2O
- 5. Гидролиз солей Водные растворы солей имеют разные значения pH и
- 6. 4 типа солей.
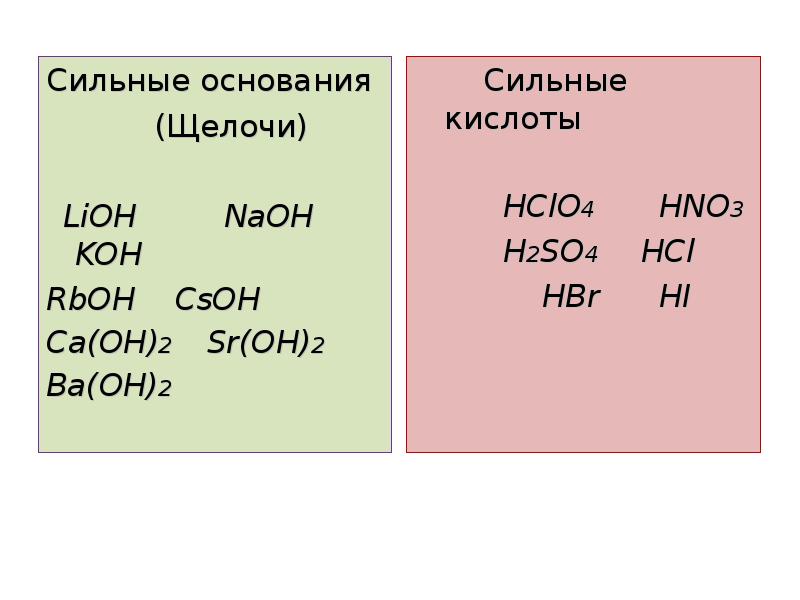
- 7. Сильные основания Сильные основания (Щелочи) LiOH NaOH
- 8. Гидролиз по аниону (соль образована сильным основанием и слабой кислотой) KNO2
- 9. Гидролиз по катиону (соль образована слабым основанием и сильной кислотой)
- 10. Необратимый гидролиз (соли образованы слабым основанием и слабой кислотой)
- 11. Изменение направления гидролиза Усиление
- 12. Применение гидролиза Основной компонент мыла – это натриевые или калиевые соли
- 13. Контрольный тест 1. Гидролиз солей – это взаимодействие с водой а)
- 14. 3. Соль, гидролизуемая по аниону, - это а) Rb2CO3
- 15. 7. В растворе соли по катиону химическая среда а) щелочная б)
- 16. Подведение итогов. Подведение итогов. Итак, сегодня мы познакомились с явлением гидролиза
- 17. Рефлексивный тест. Рефлексивный тест. Я узнал (а) много нового.
- 18. Домашняя работа § 18 страница 155 № 8
- 19. Скачать презентацию
















Слайды и текст этой презентации
Скачать презентацию на тему Гидролиз. Применение гидролиза. (11 класс) можно ниже:
Похожие презентации





























