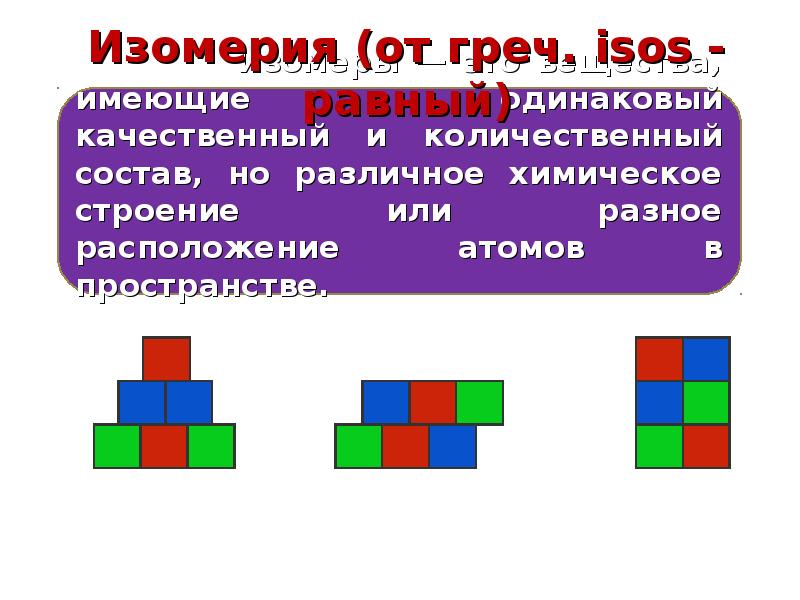
Изомерия. Кислотность органических соединений презентация
Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о структурной и
- 3. ПЛАН ЛЕКЦИИ ПЛАН ЛЕКЦИИ Изомерия. Кислотность и основность органических соединений.
- 4. Медико-биологическое значение темы Для биоорганической и биологической химии изомерия является причиной
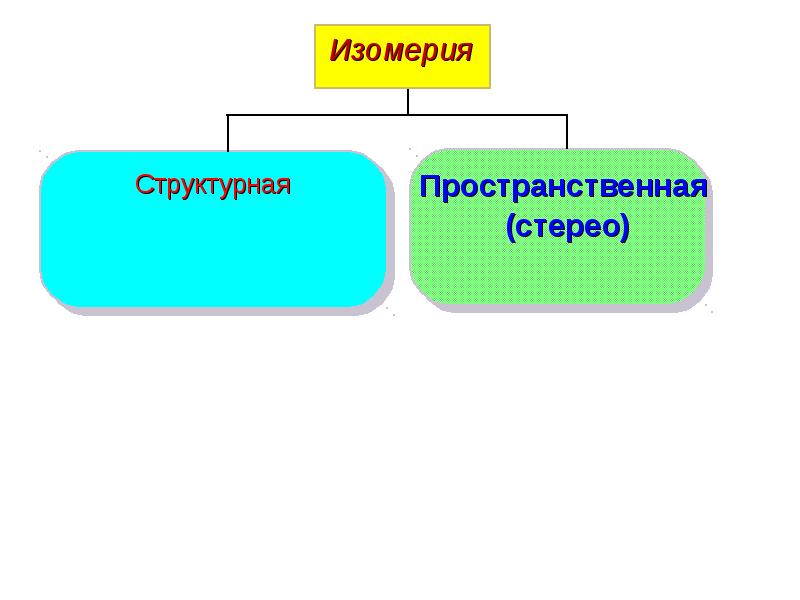
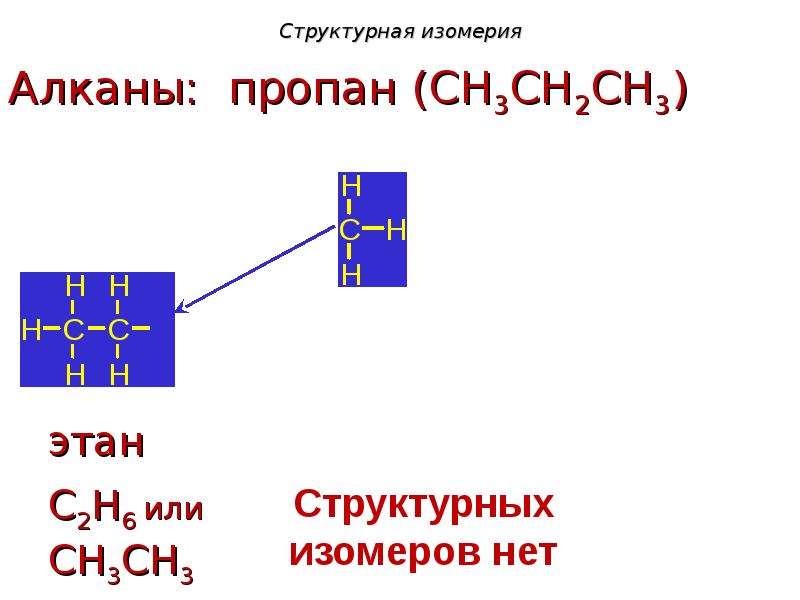
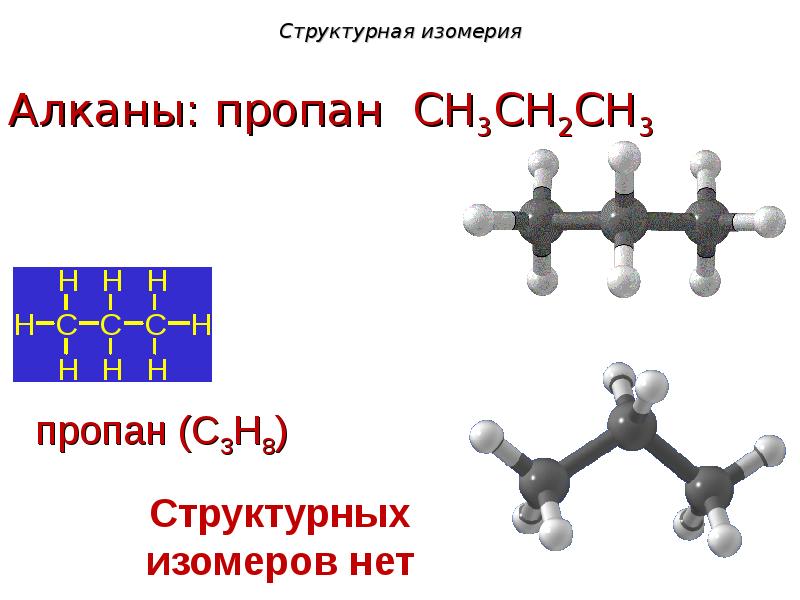
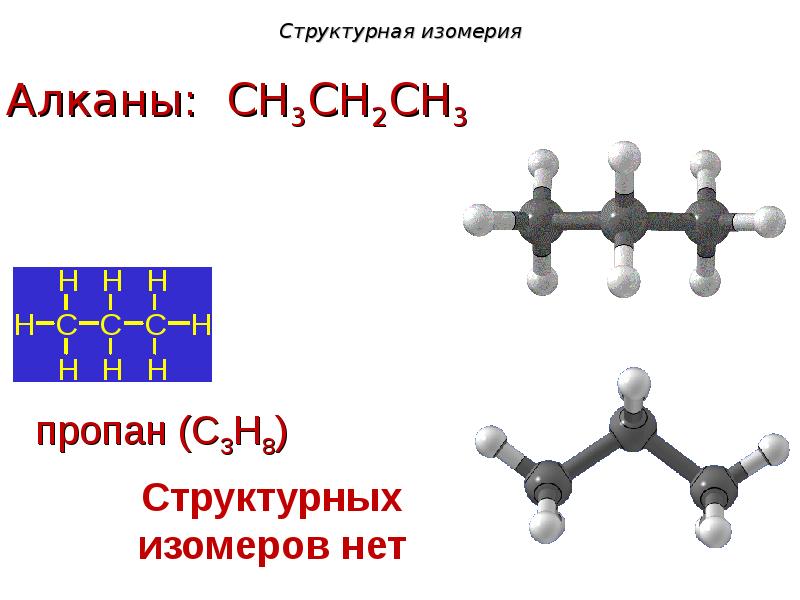
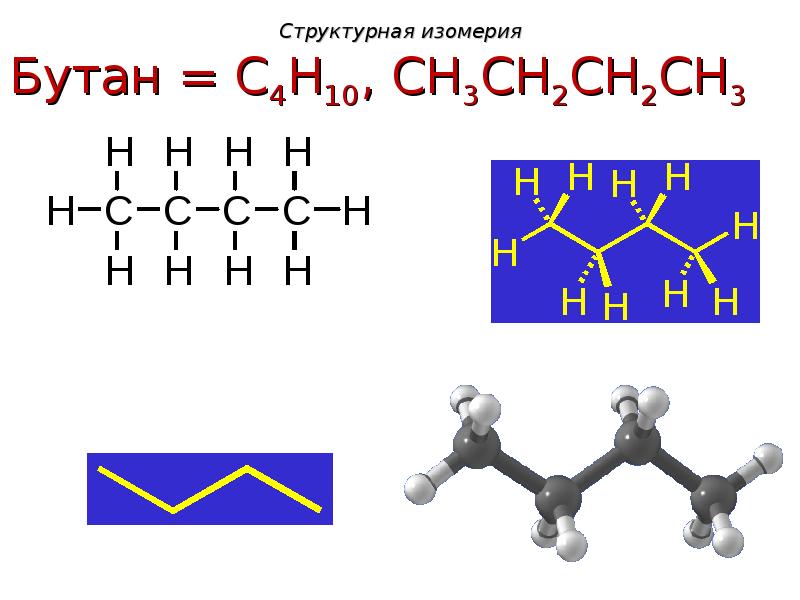
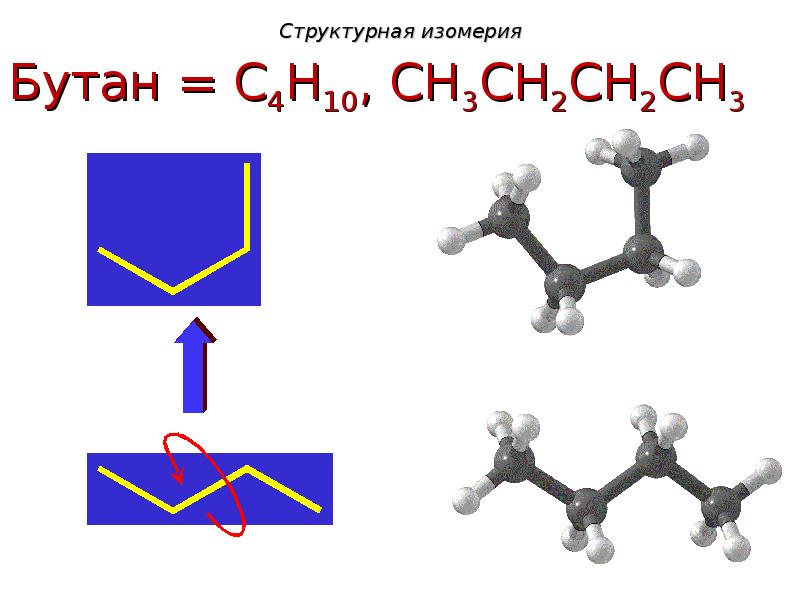
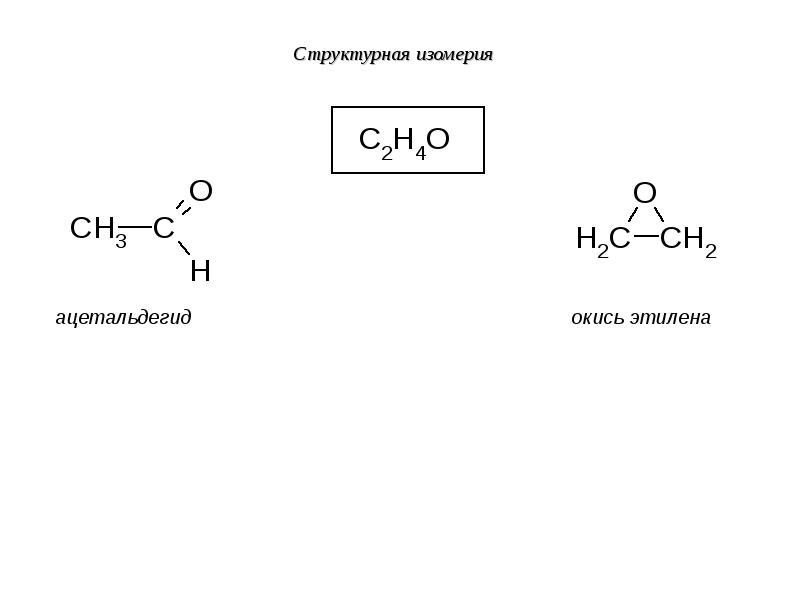
- 7. Структурная изомерия
- 8. Структурная изомерия
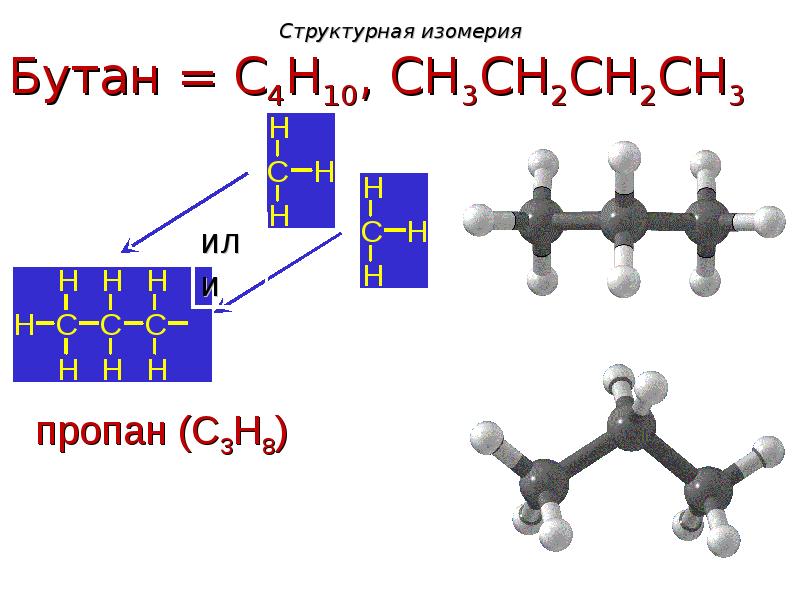
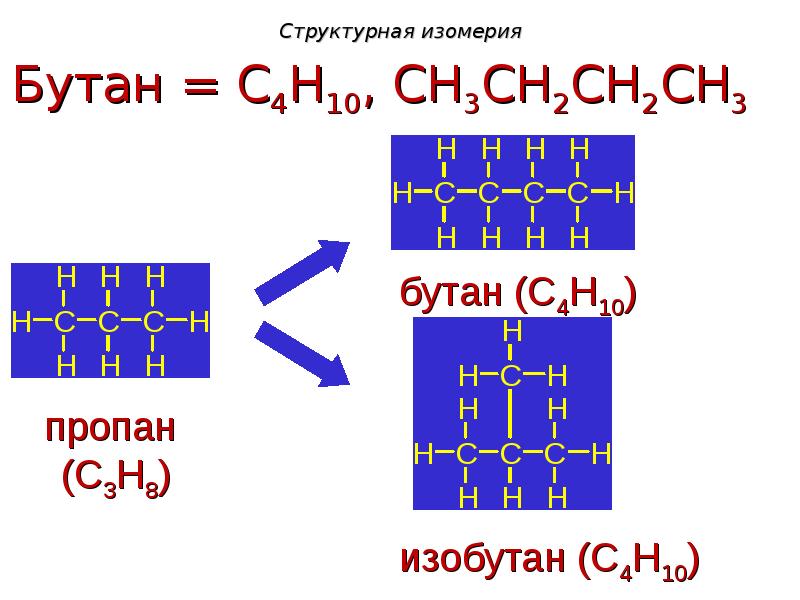
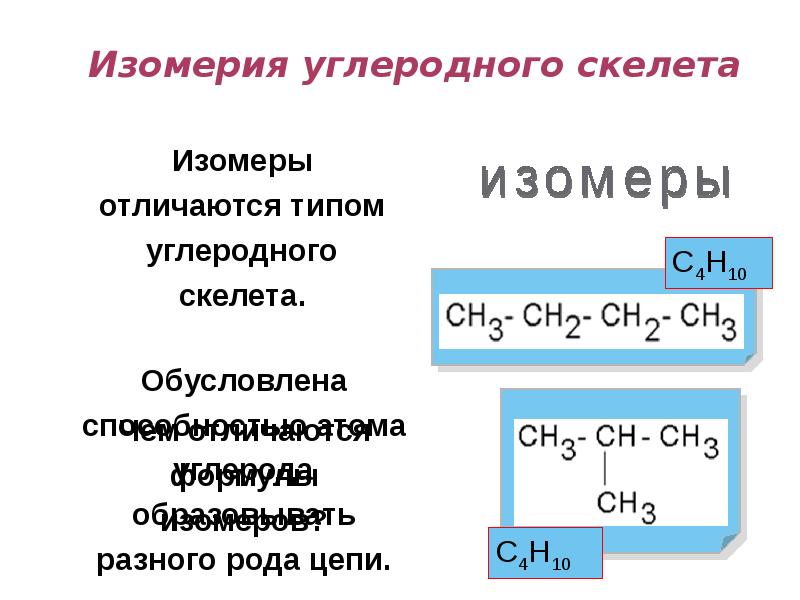
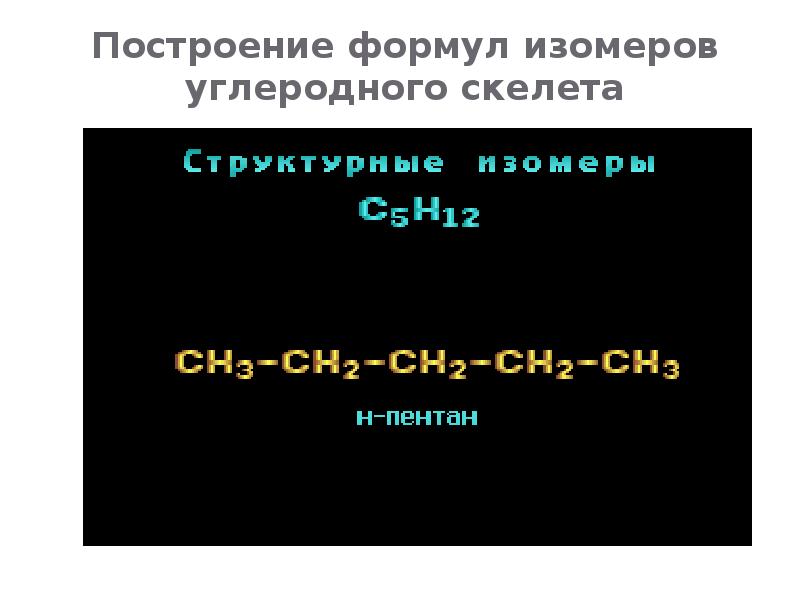
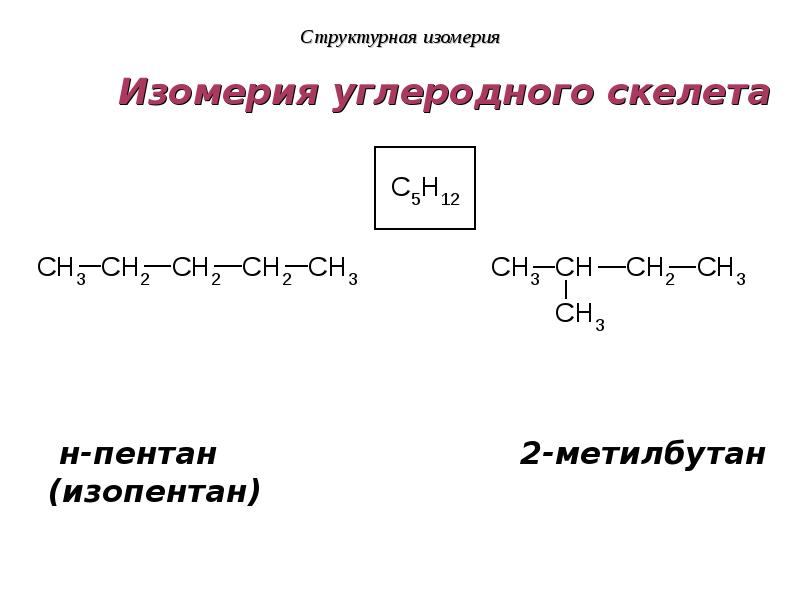
- 16. Изомерия углеродного скелета
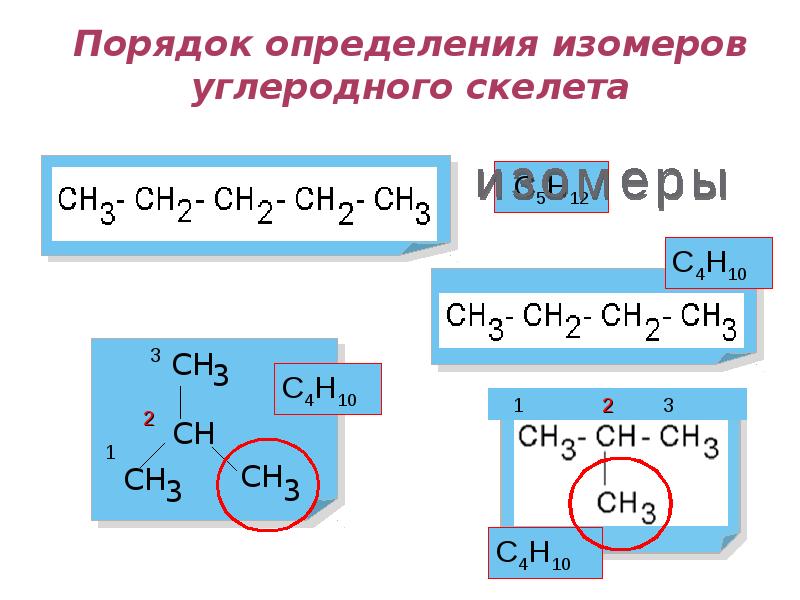
- 17. Порядок определения изомеров углеродного скелета
- 19. Структурная изомерия Изомерия углеродного скелета
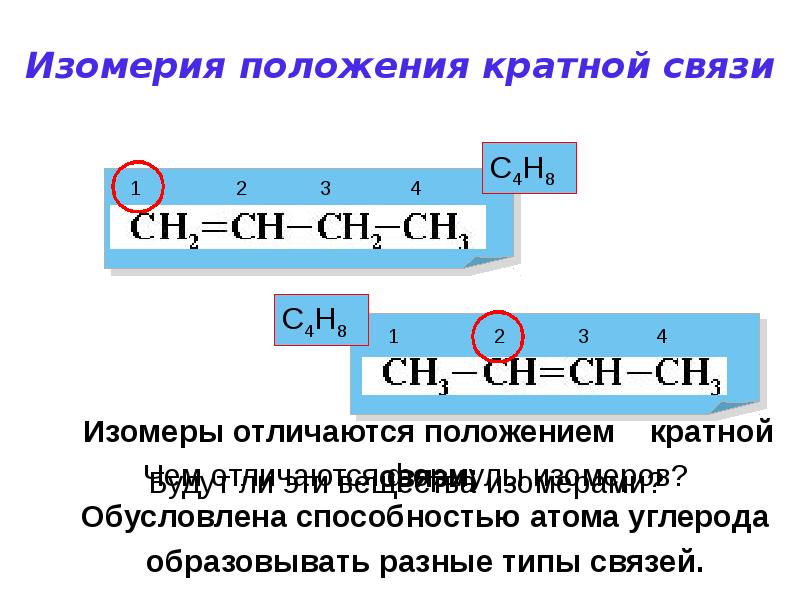
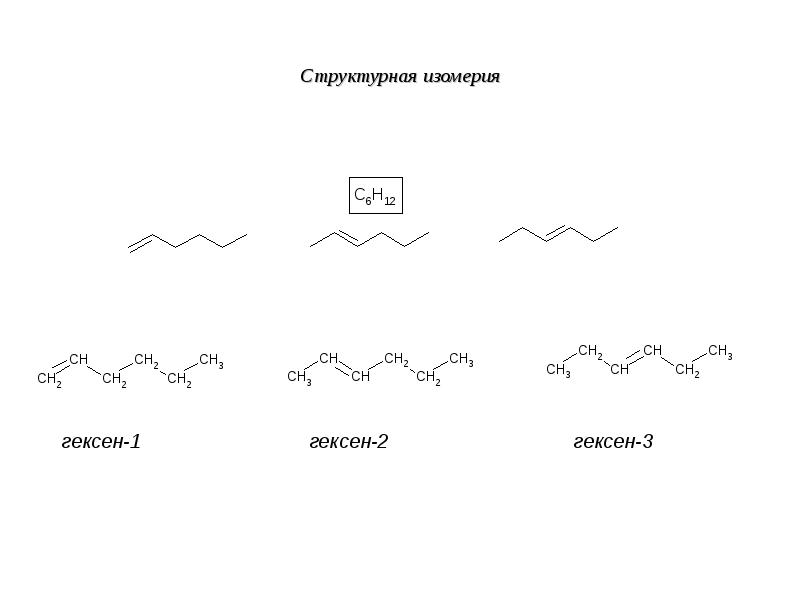
- 20. Изомерия положения кратной связи
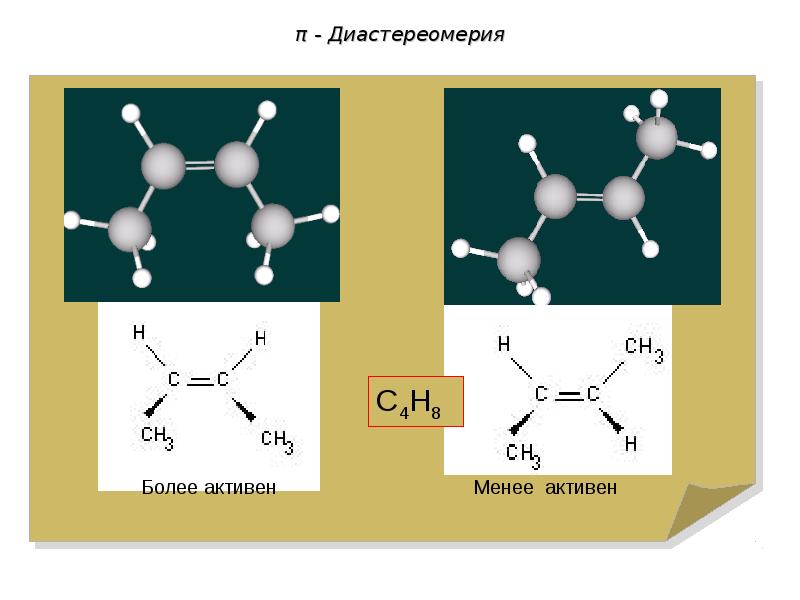
- 21. Структурная изомерия Изомерия положения кратной связи С4Н8
- 22. Структурная изомерия
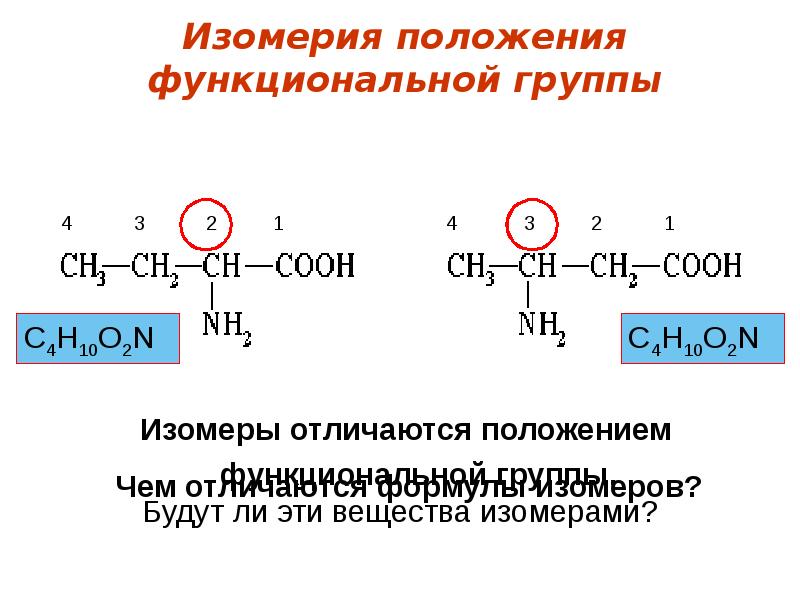
- 23. Изомерия положения функциональной группы
- 24. Структурная изомерия Изомерия положения функциональных групп:
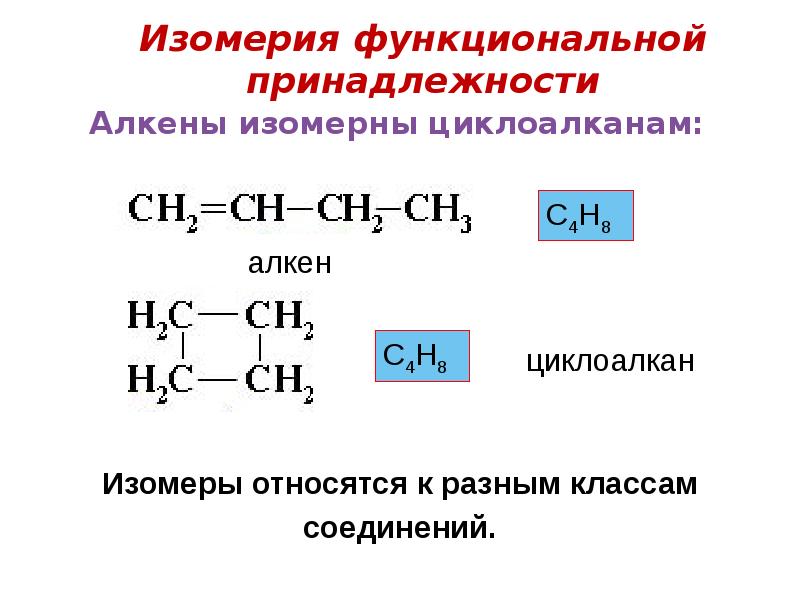
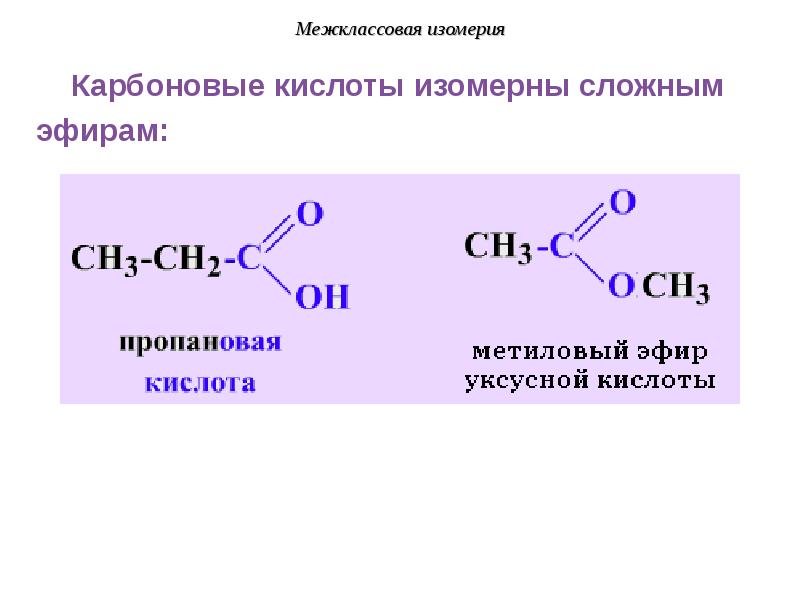
- 25. Изомерия функциональной принадлежности
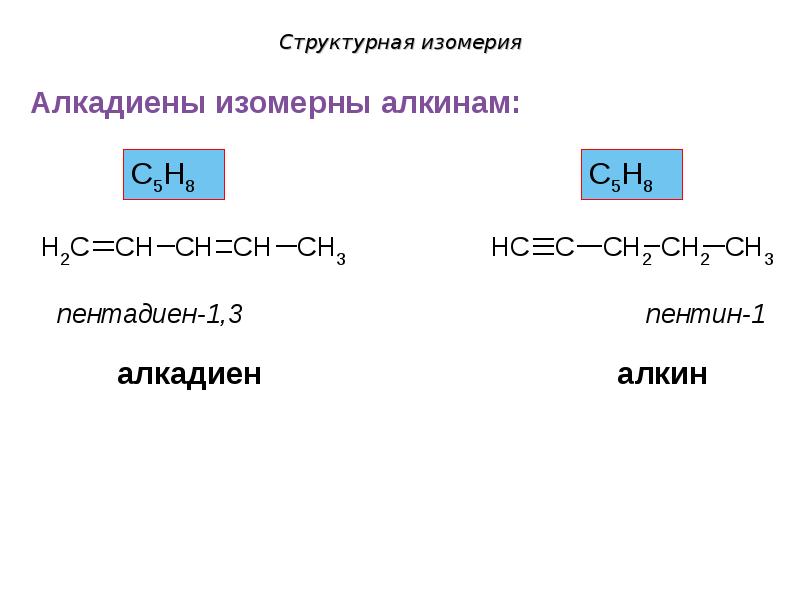
- 26. Структурная изомерия
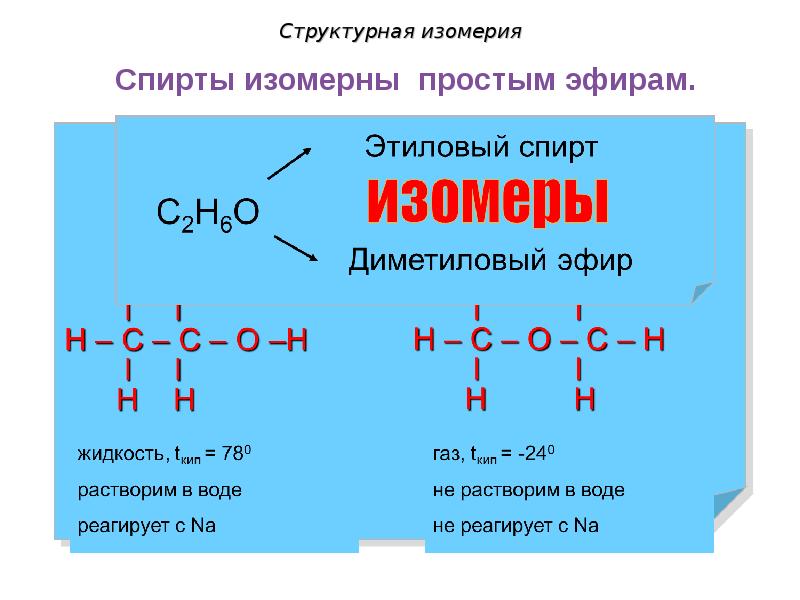
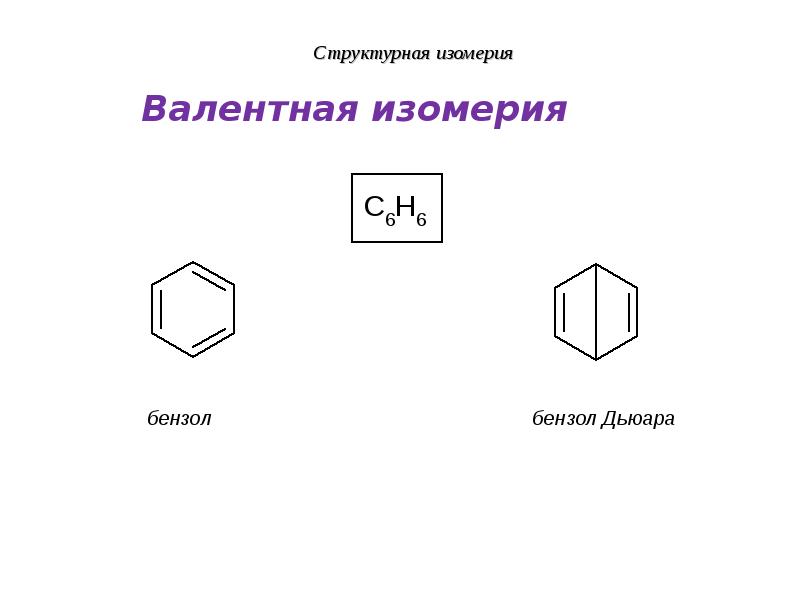
- 29. Структурная изомерия
- 30. Структурная изомерия
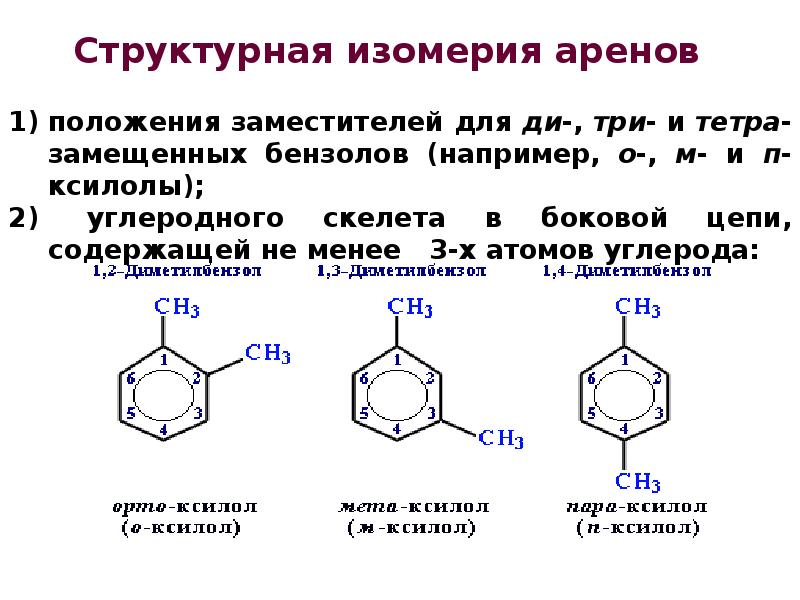
- 31. Структурная изомерия аренов
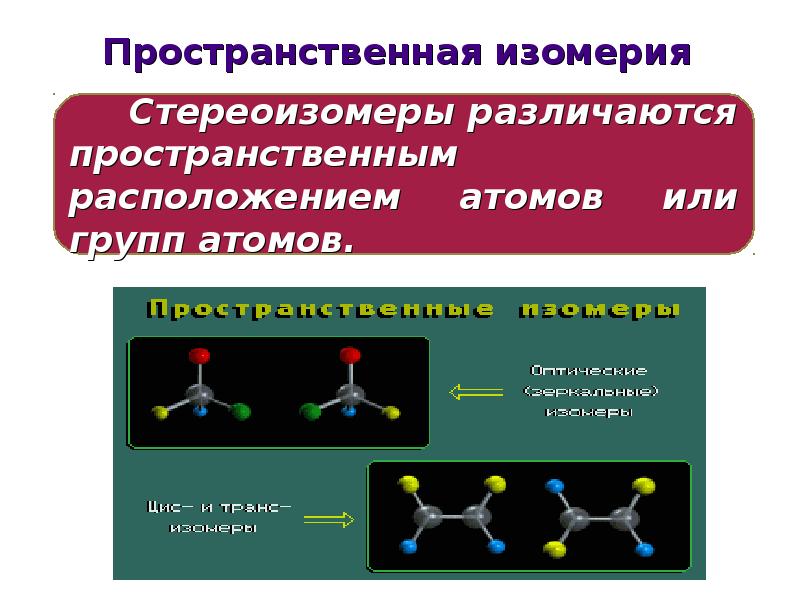
- 32. Пространственная изомерия
- 33. Различают виды стереоизомерии: Различают виды стереоизомерии: энантиомерия σ–диастереомерия π-диастереомерия (геометрическая)
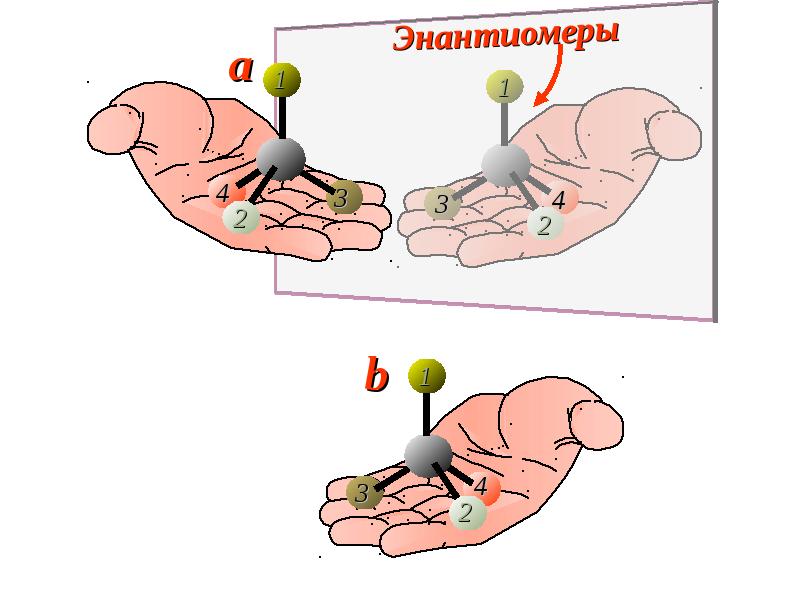
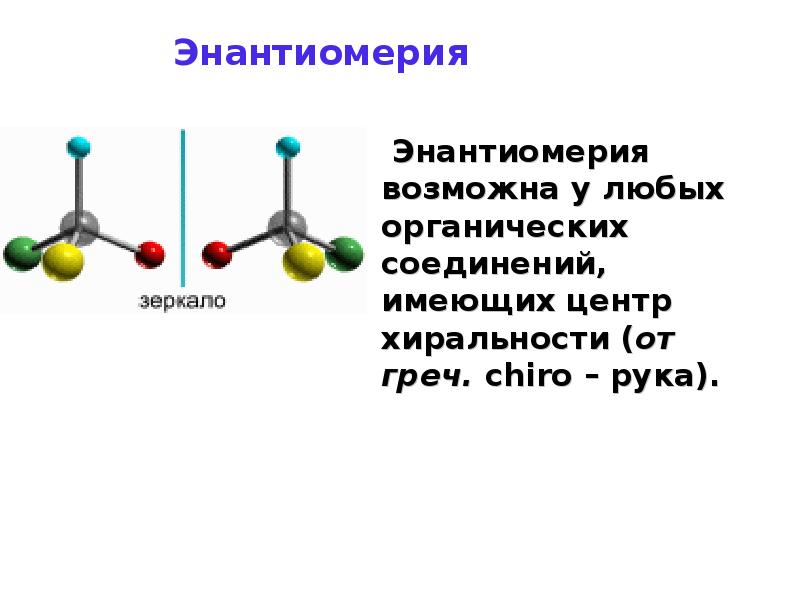
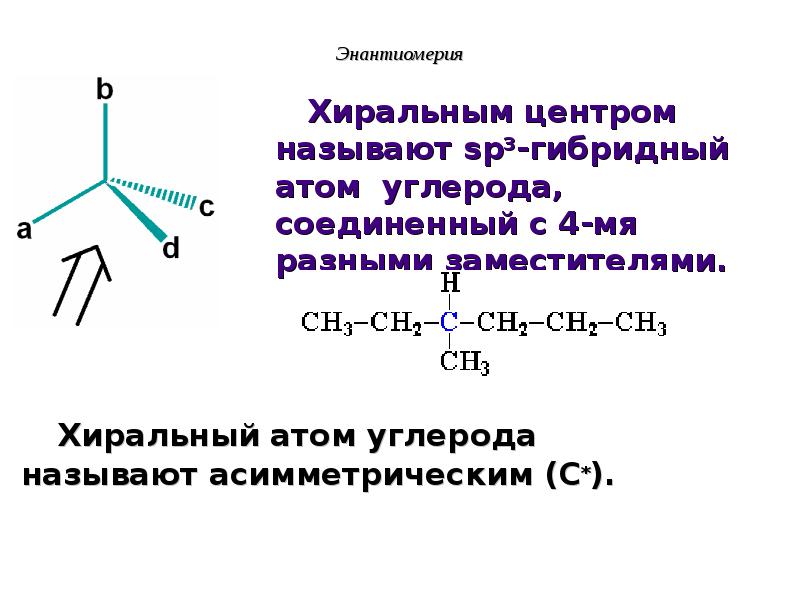
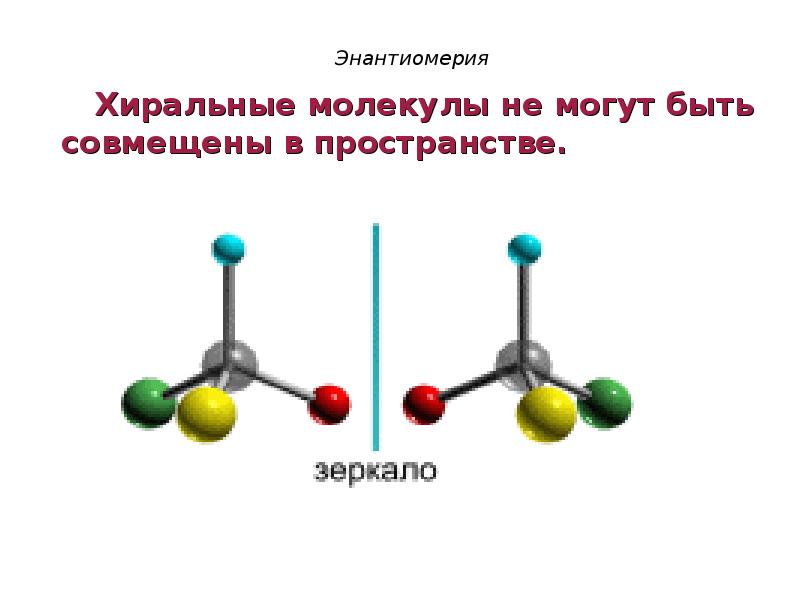
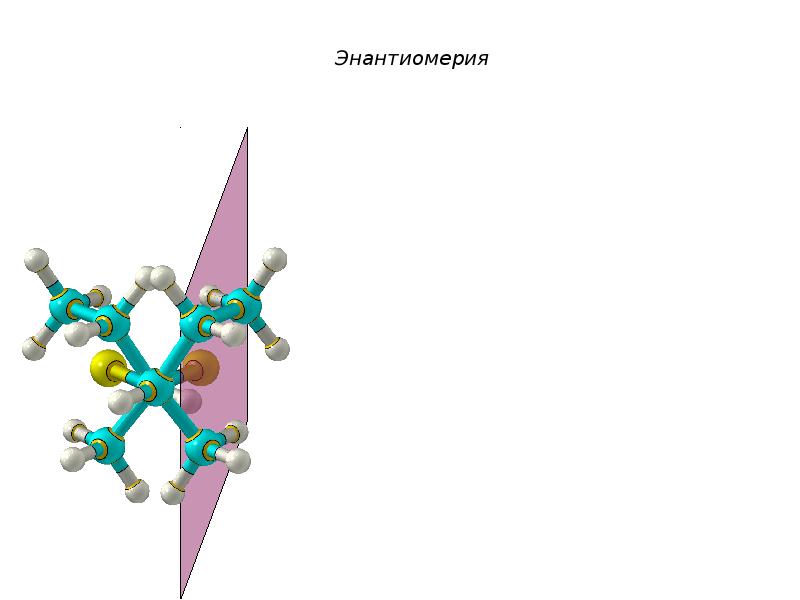
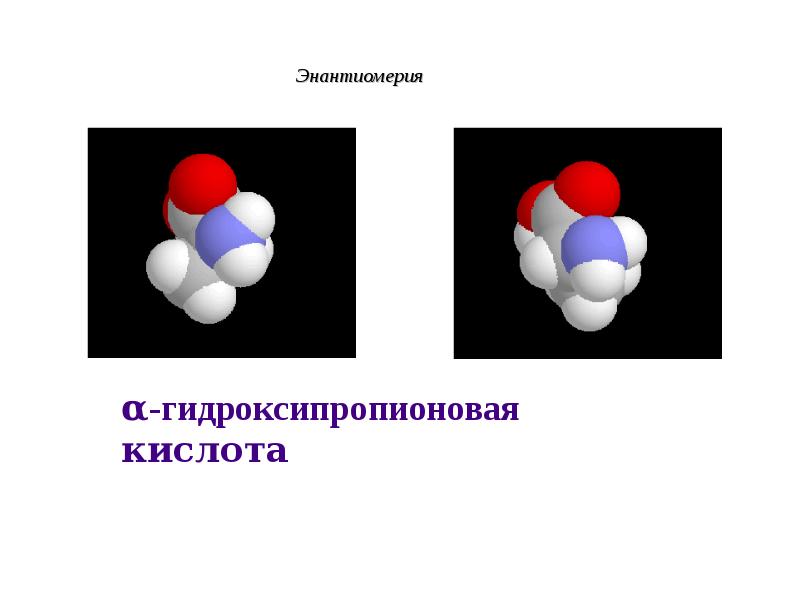
- 37. Энантиомерия Хиральный атом углерода называют асимметрическим (C*).
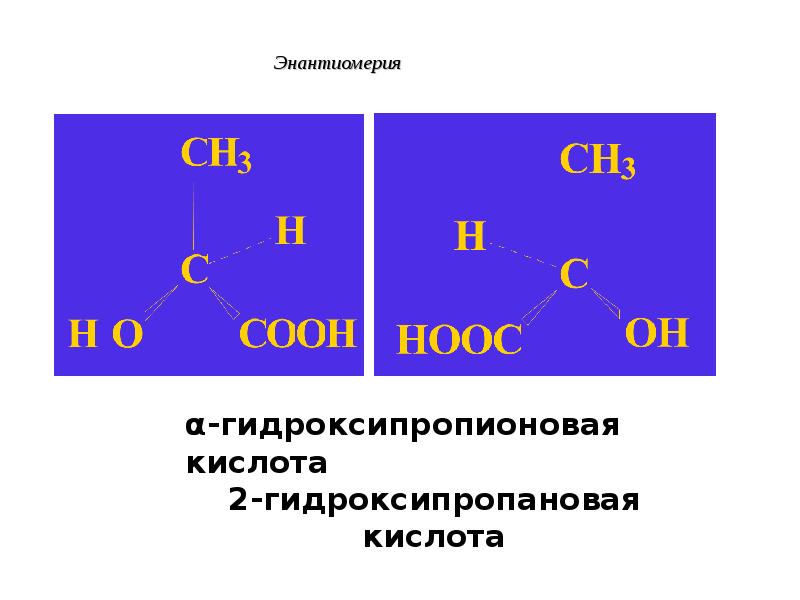
- 45. Пример: хиральная молекула Пример: хиральная молекула 2-гидроксипропановая кислота СН3-СН(ОН)-СООН
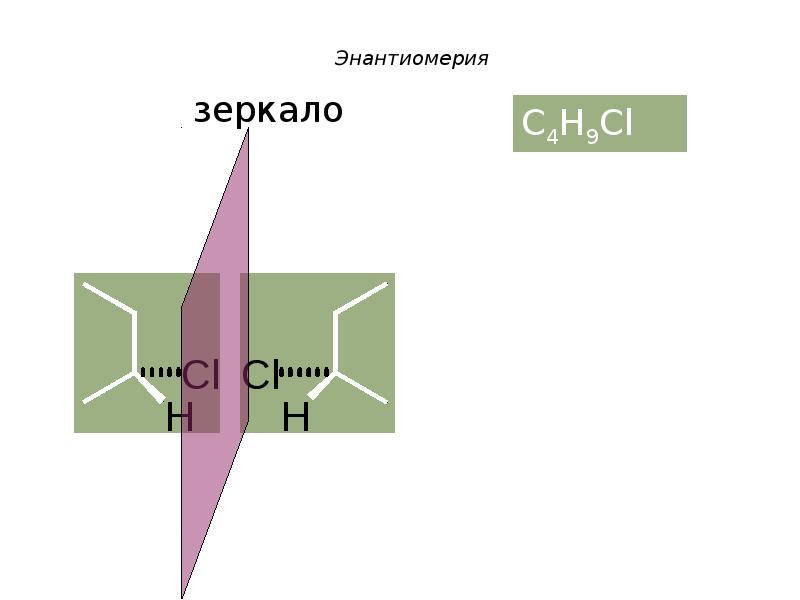
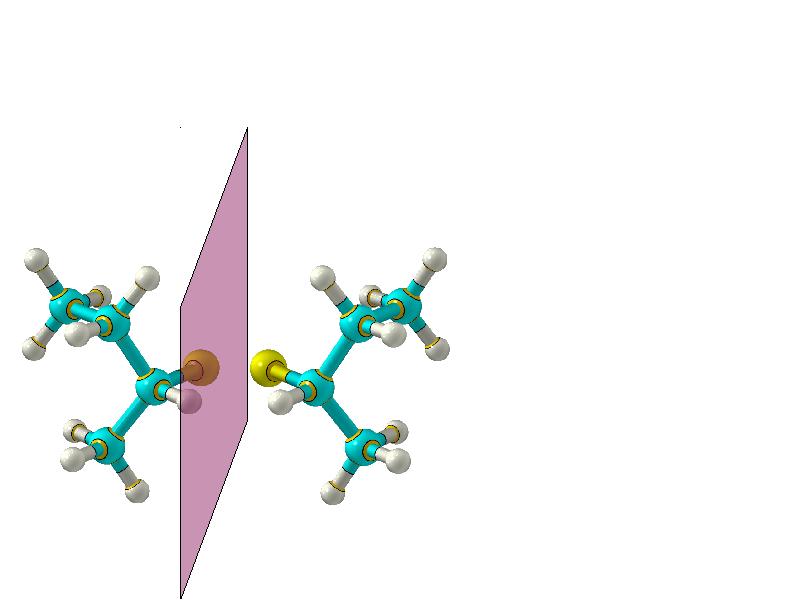
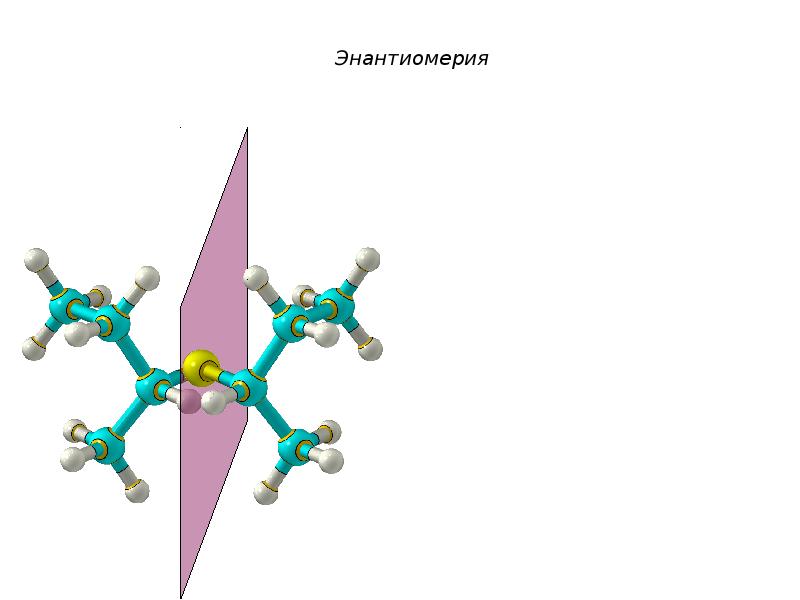
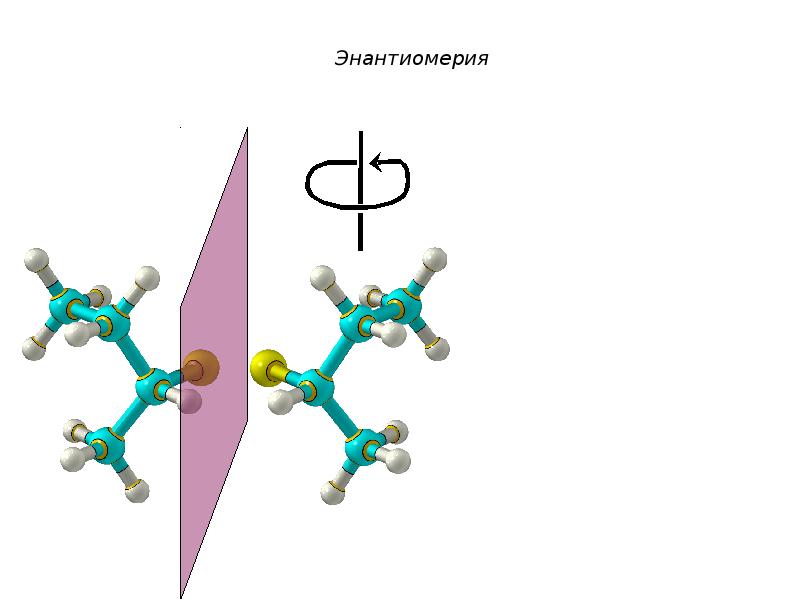
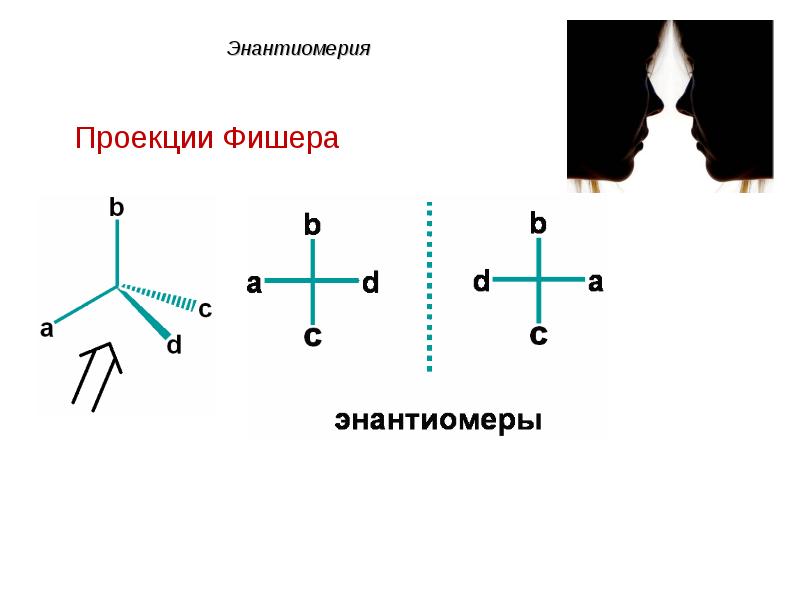
- 46. Энантиомерия
- 47. Энантиомерия
- 48. Энантиомерия
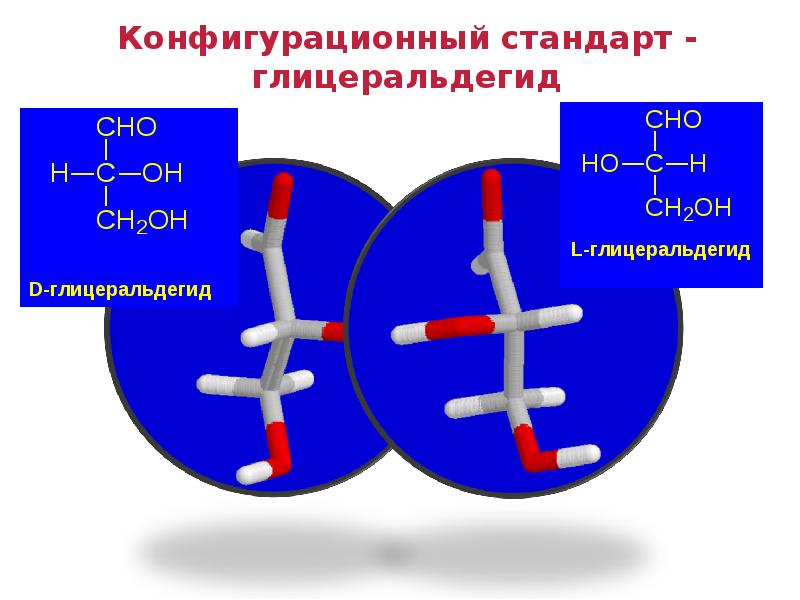
- 49. Энантиомерия В зависимости от конфигурации хирального центра различают D- и
- 50. Конфигурационный стандарт - глицеральдегид
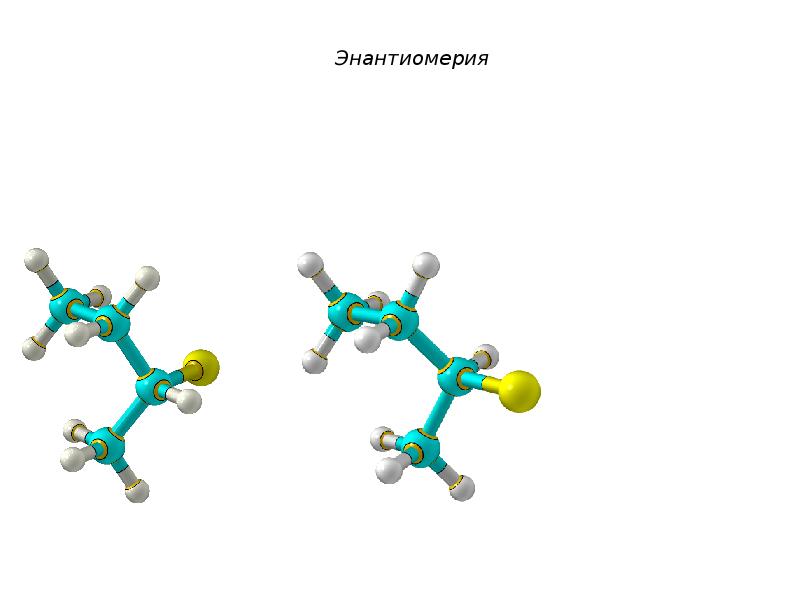
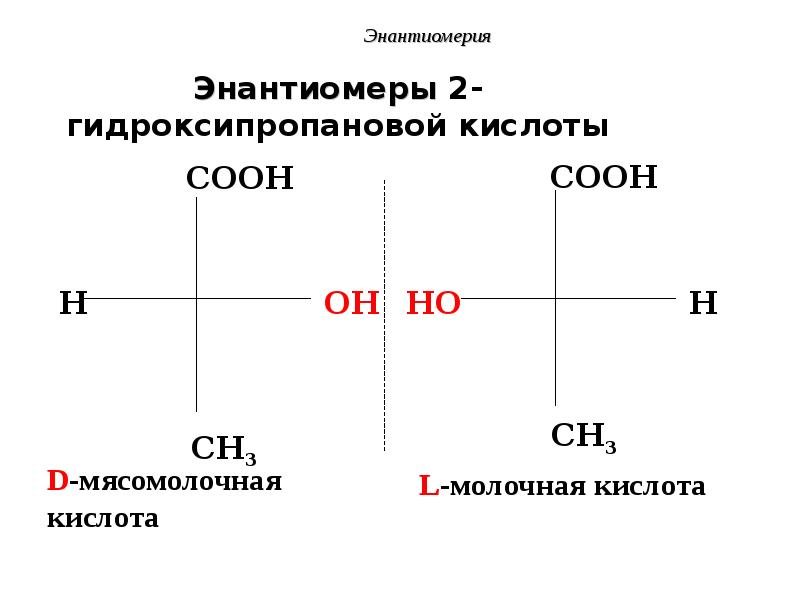
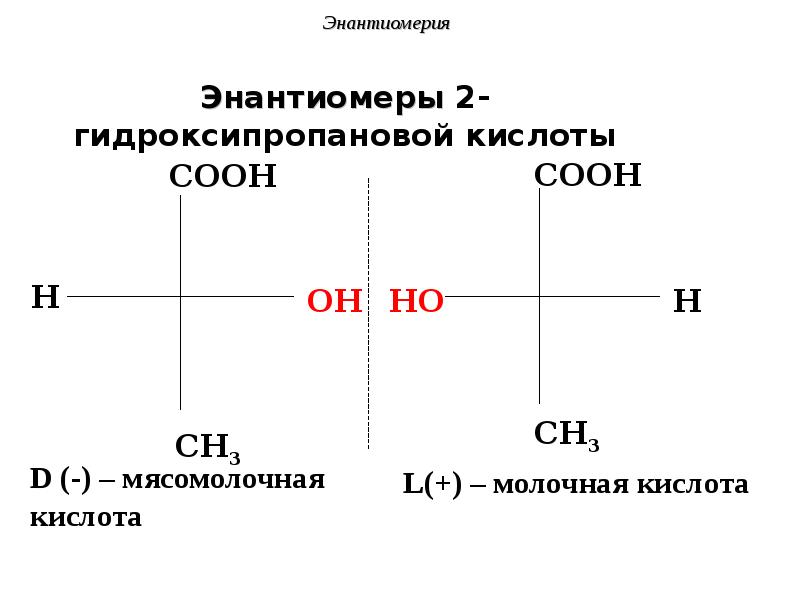
- 52. Энантиомеры 2-гидроксипропановой кислоты
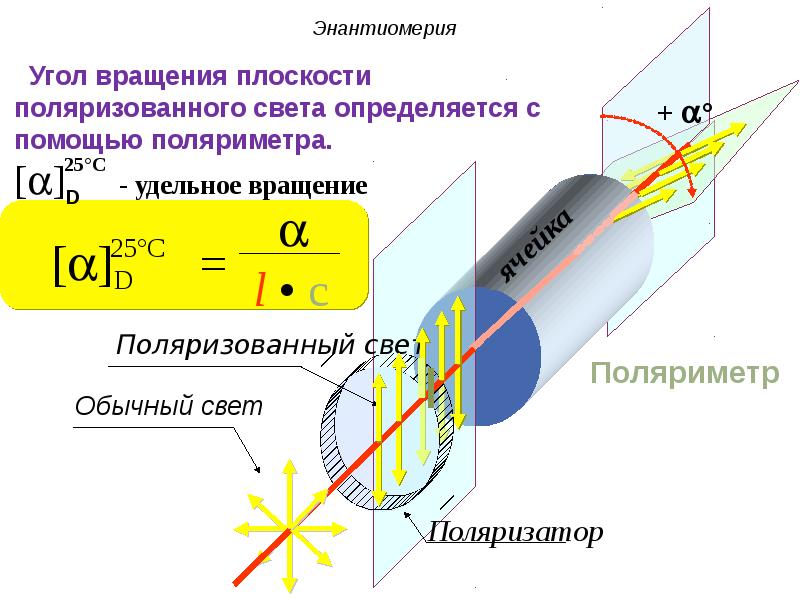
- 53. Энантиомерия Энантиомеры обладают оптической активностью. Они способны вращать плоскость поляризации
- 55. Энантиомерия Энантиомеры способны отклонять поляризованный луч либо влево, либо вправо,
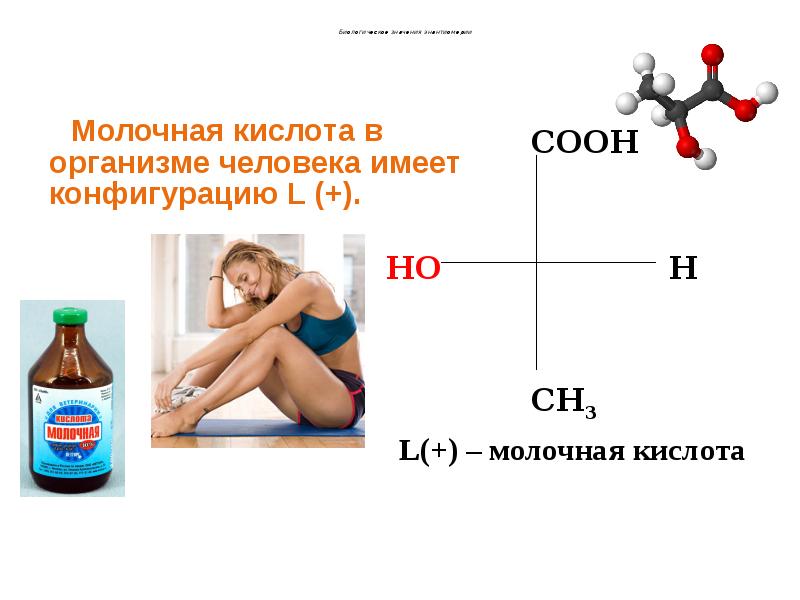
- 56. Энантиомерия У 2-гидроксипропановой кислоты D-изомер является левовращающим (-):
- 57. Энантиомеры 2-гидроксипропановой кислоты
- 58. Энантиомерия Энантиомеры обладают одинаковыми физическими и химическими свойствами, но являются
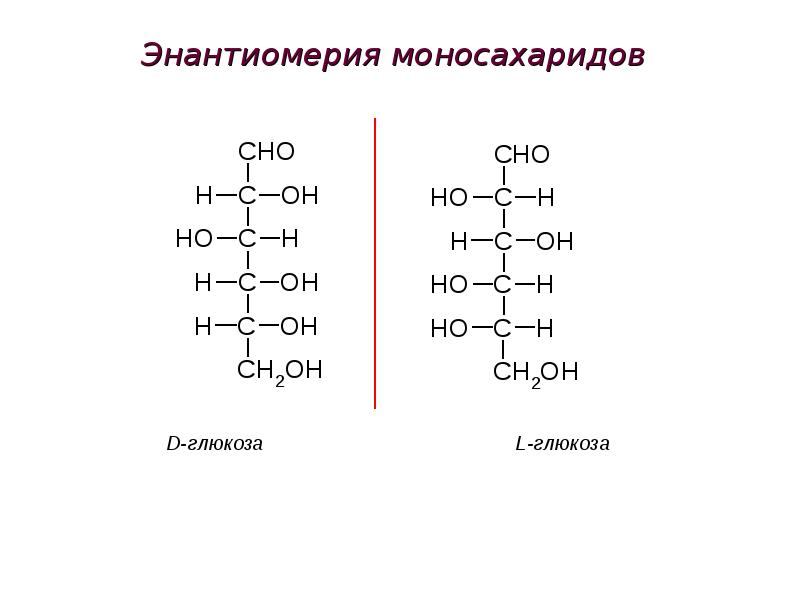
- 59. Энантиомерия моносахаридов
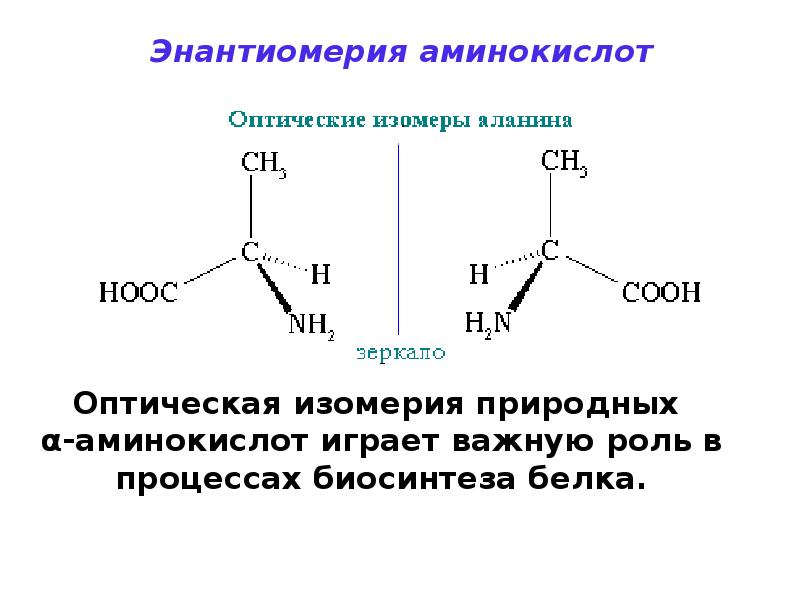
- 60. Энантиомерия аминокислот
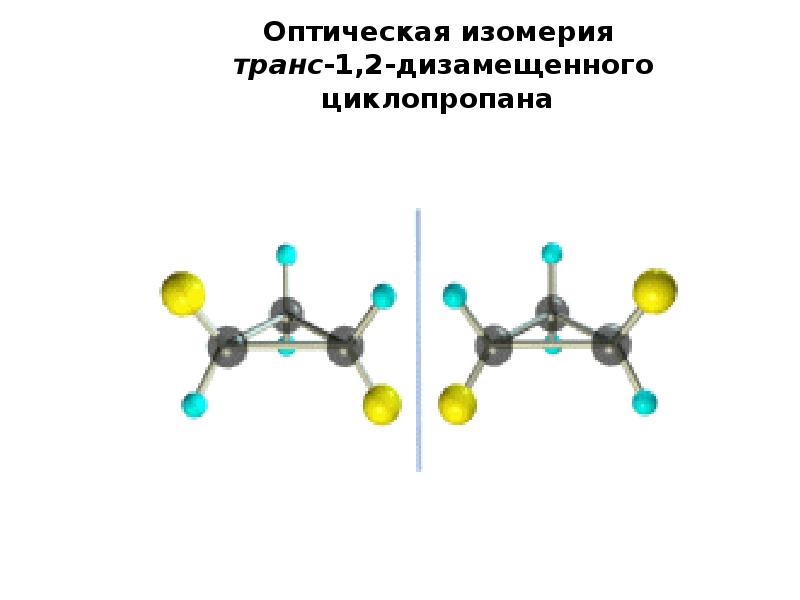
- 61. Оптическая изомерия транс-1,2-дизамещенного циклопропана
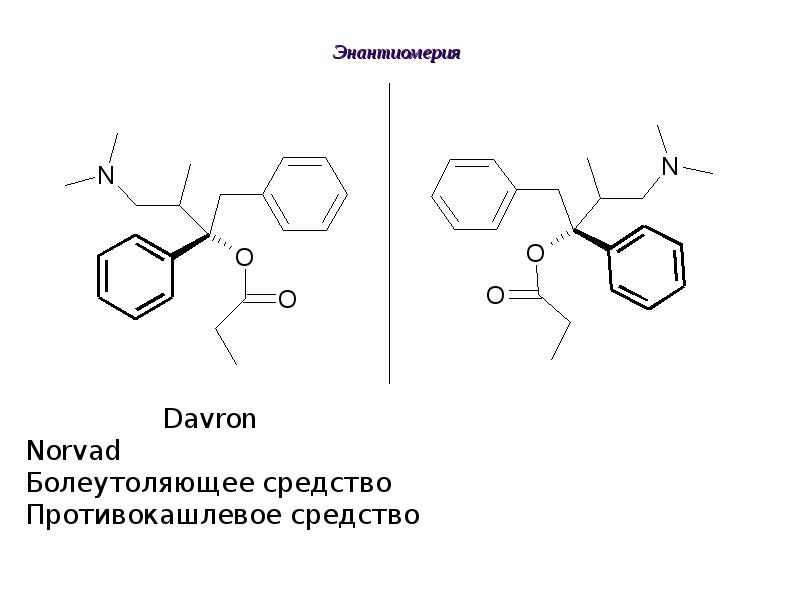
- 62. Энантиомерия
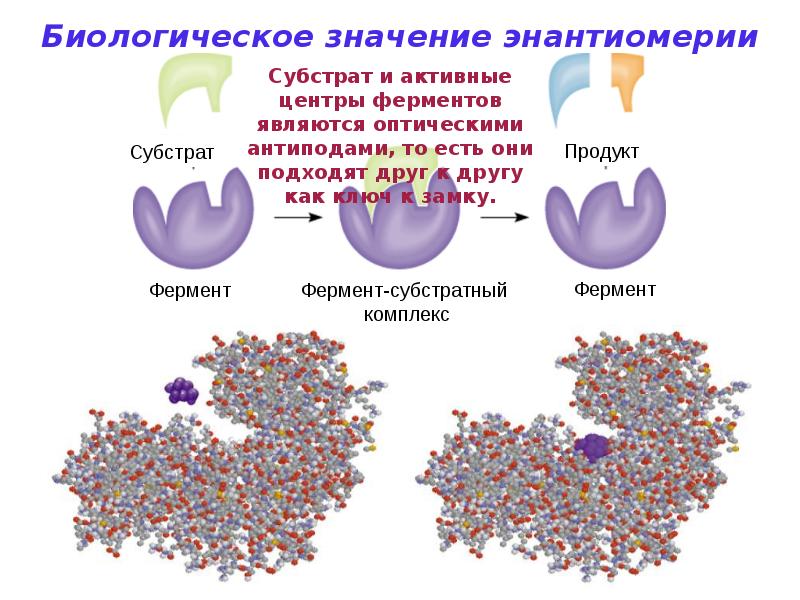
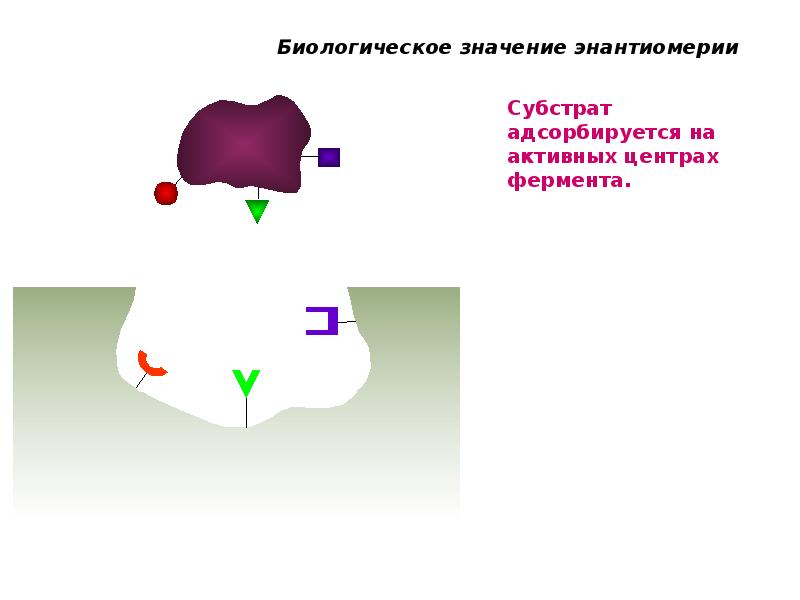
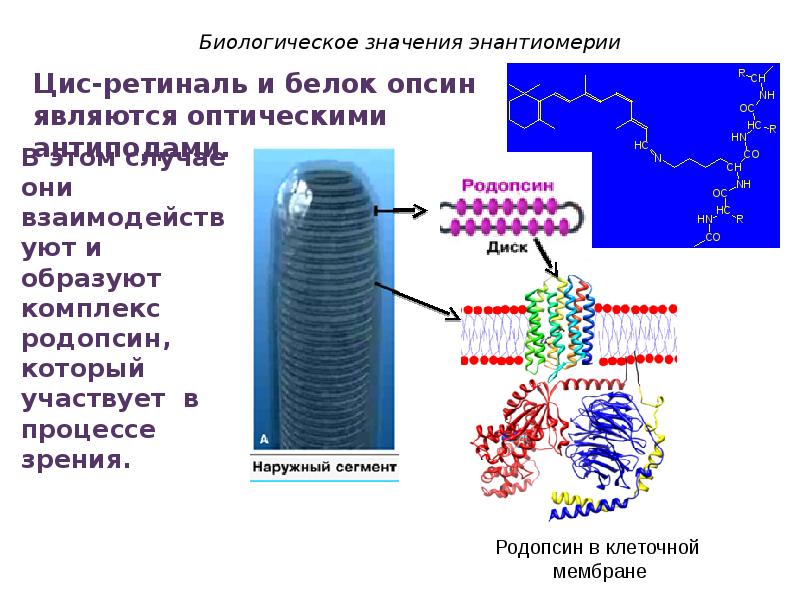
- 66. Биологическое значения энантиомерии В этом случае они взаимодействуют и образуют
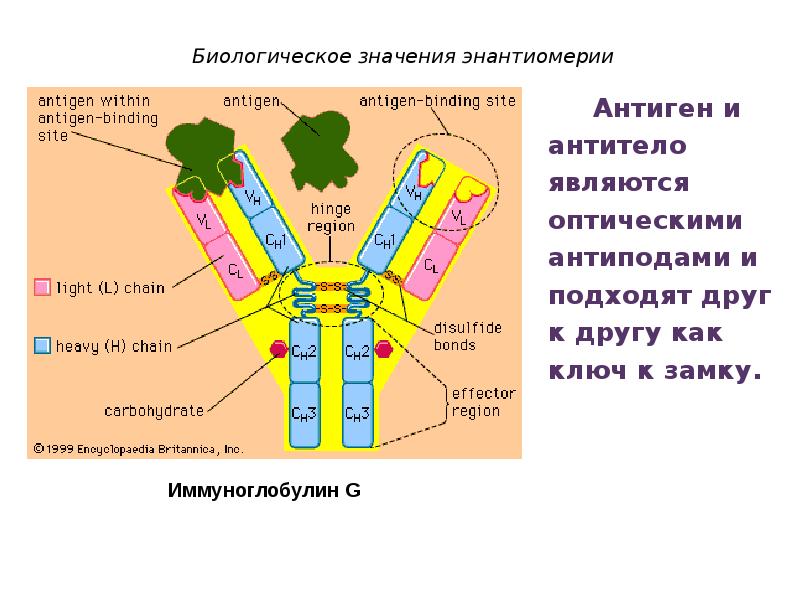
- 67. Биологическое значения энантиомерии Антиген и антитело являются оптическими антиподами
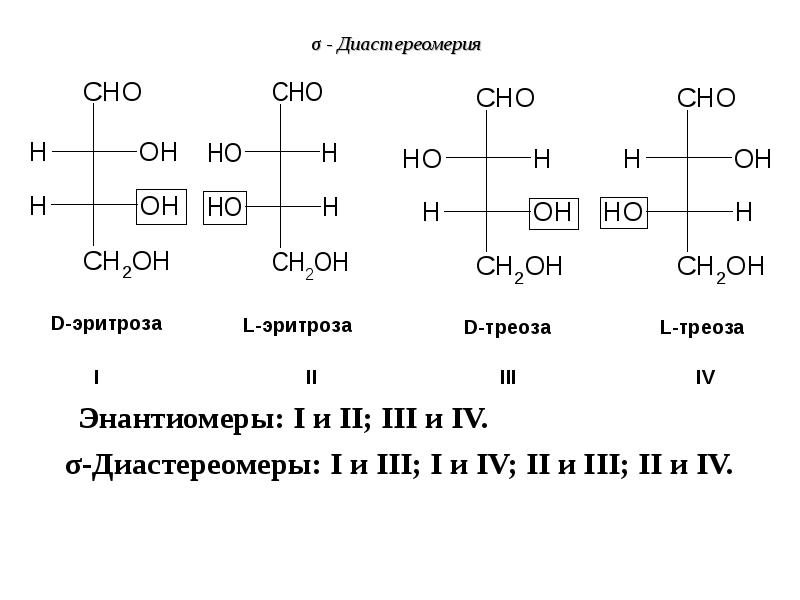
- 71. σ - Диастереомерия Пример: 2,3,4 – тригидроксибутаналь СН2(ОН)-СН(ОН)-СН(ОН)-СОН n=2; Z
- 72. σ - Диастереомерия
- 73. σ - Диастереомерия σ– Диастереомеры имеют разные физические и химические
- 74. π - Диастереомерия
- 75. Геометрическая изомерия
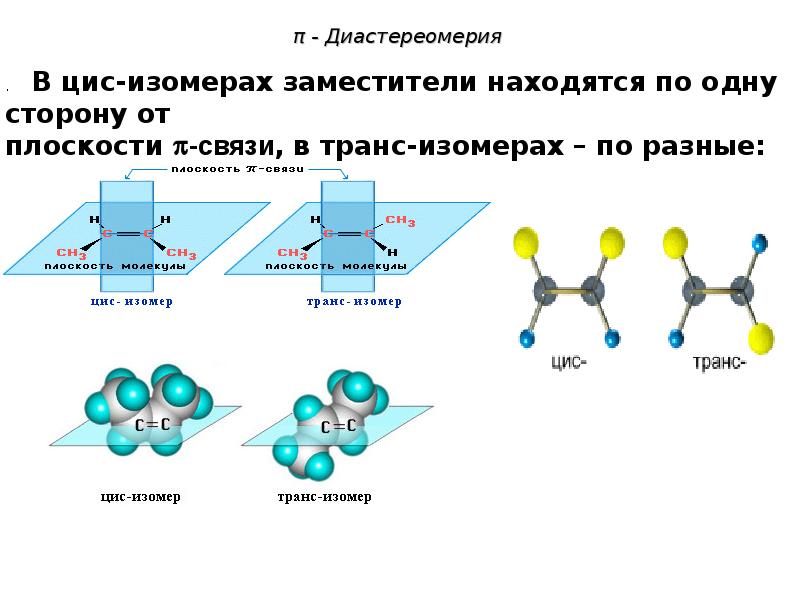
- 76. π - Диастереомерия
- 77. π - Диастереомерия
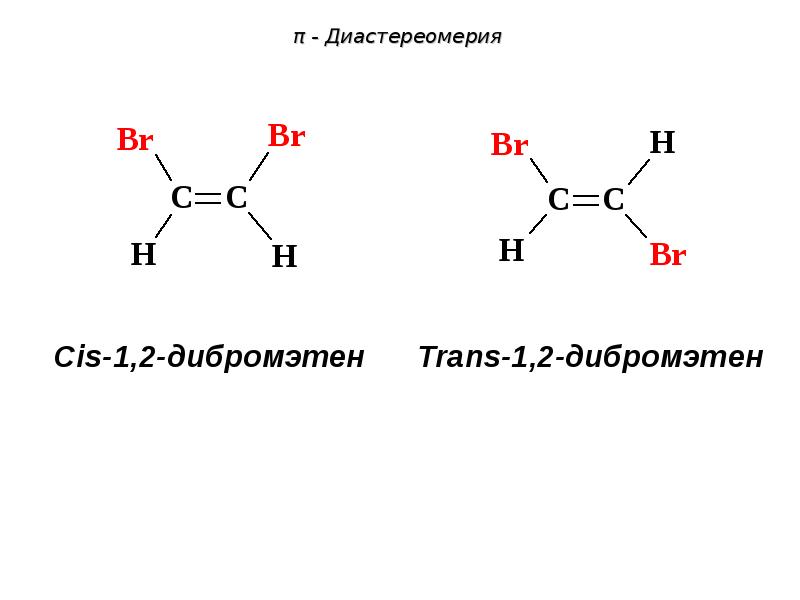
- 78. π - Диастереомерия
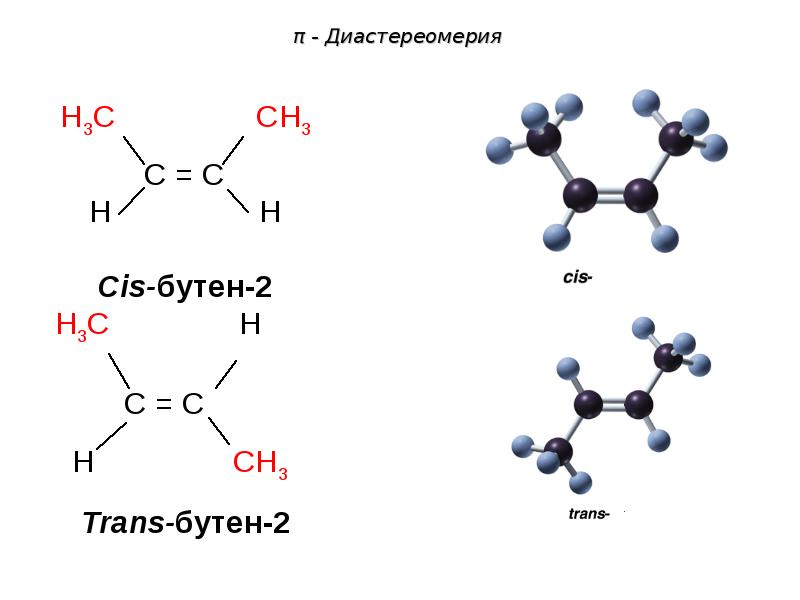
- 79. π - Диастереомерия
- 80. π - Диастереомерия
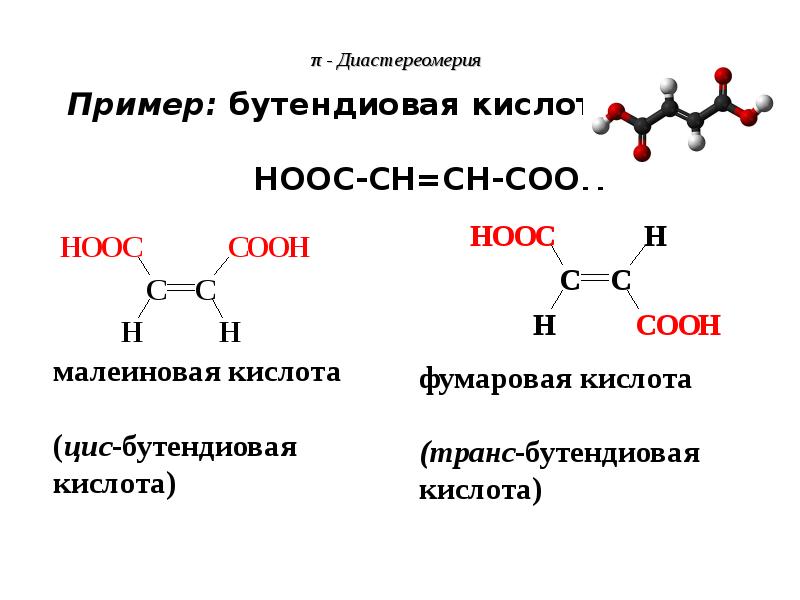
- 81. π - Диастереомерия -Диастереомеры отличаются друг от друга по физическим
- 82. π - Диастереомерия Фумаровая кислота содержится как в растительных, так
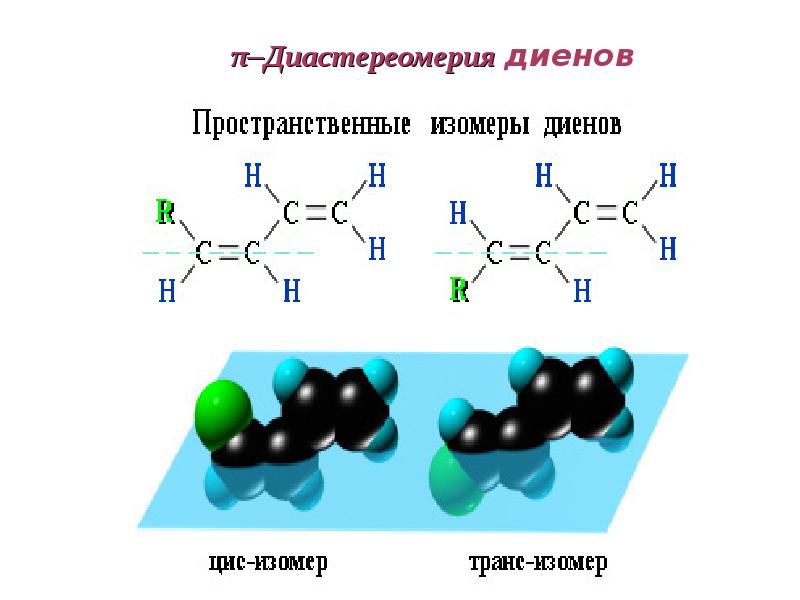
- 83. π–Диастереомерия диенов
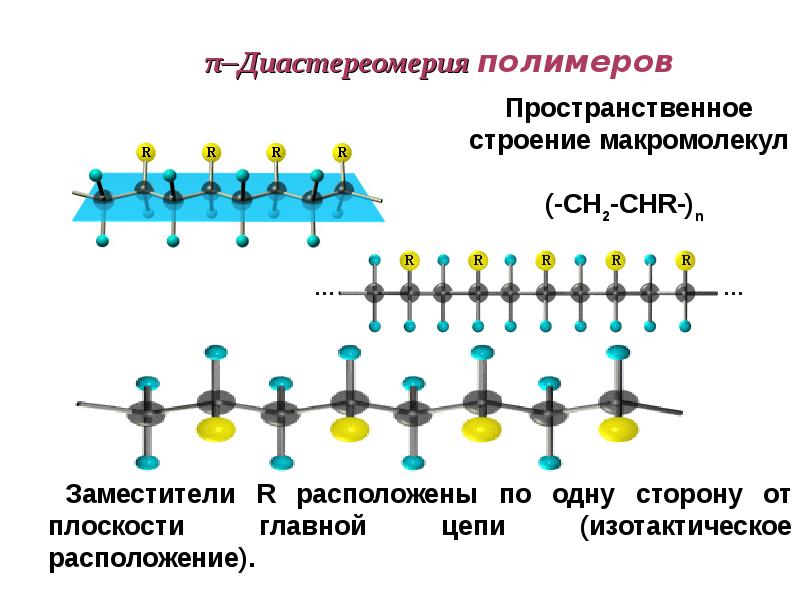
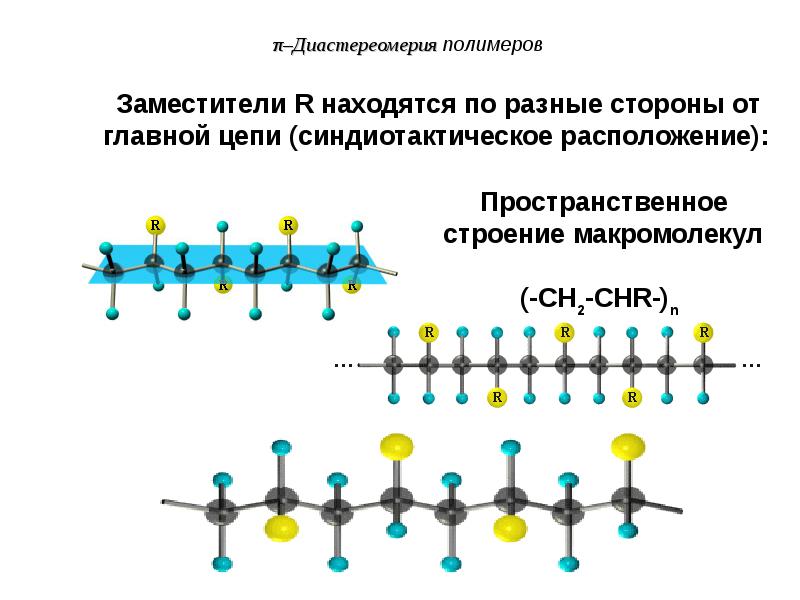
- 84. π–Диастереомерия полимеров
- 86. Биологическое значение π-диастереомерии
- 87. Биологическое значение π-диастереомерии Высшие ненасыщенные жирные кислоты в составе липидов имеют
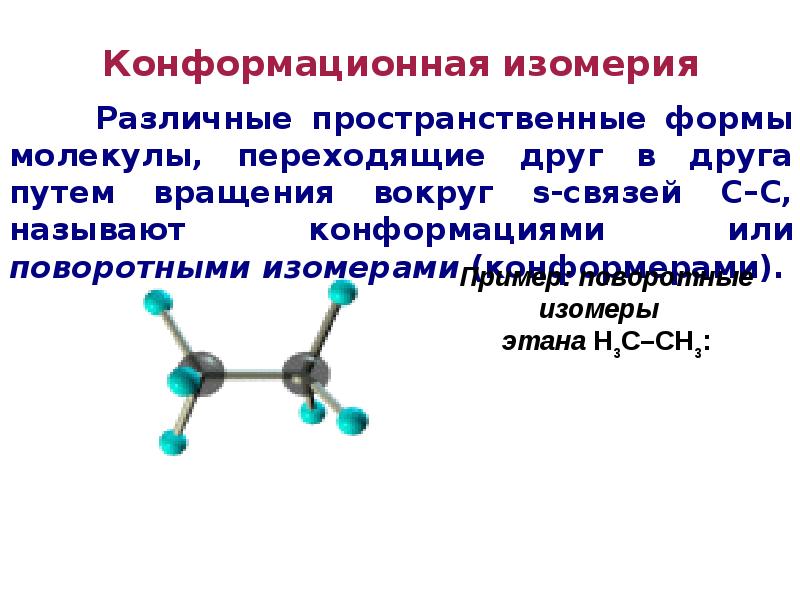
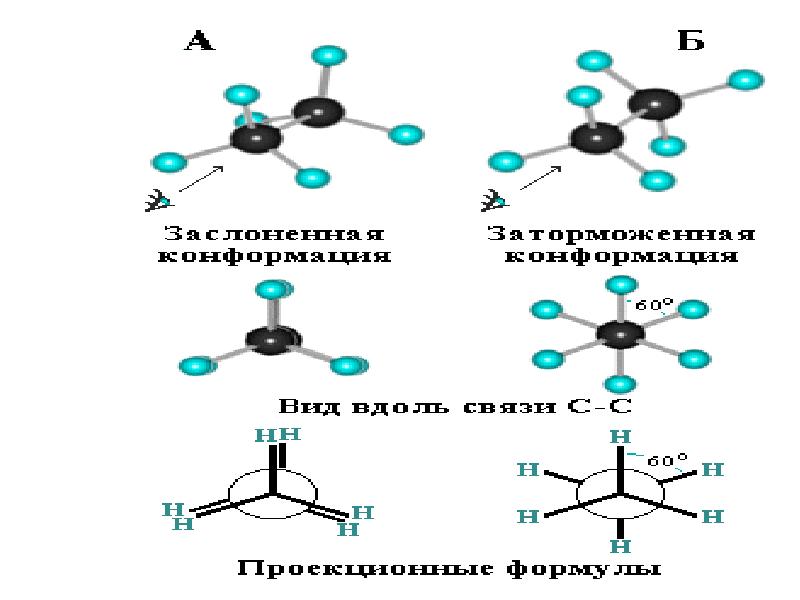
- 88. Конформационная изомерия
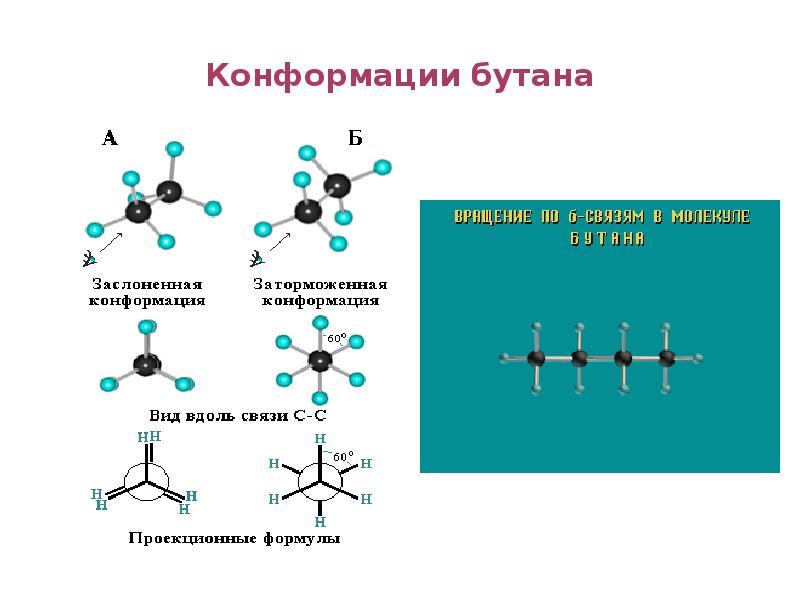
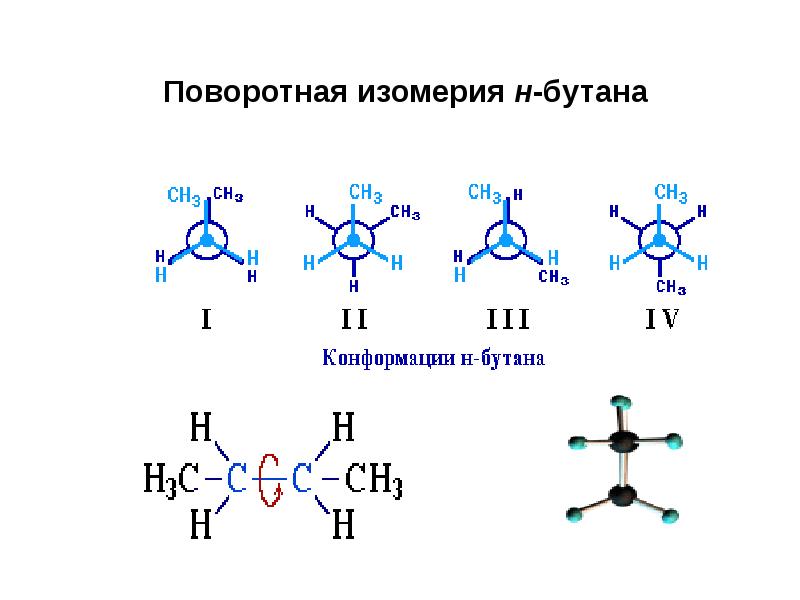
- 90. Конформации бутана
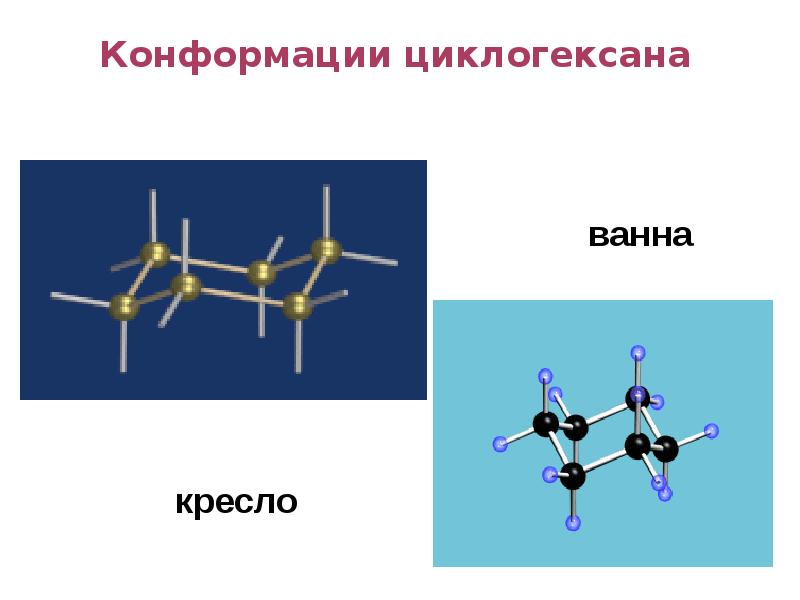
- 92. Конформации циклогексана
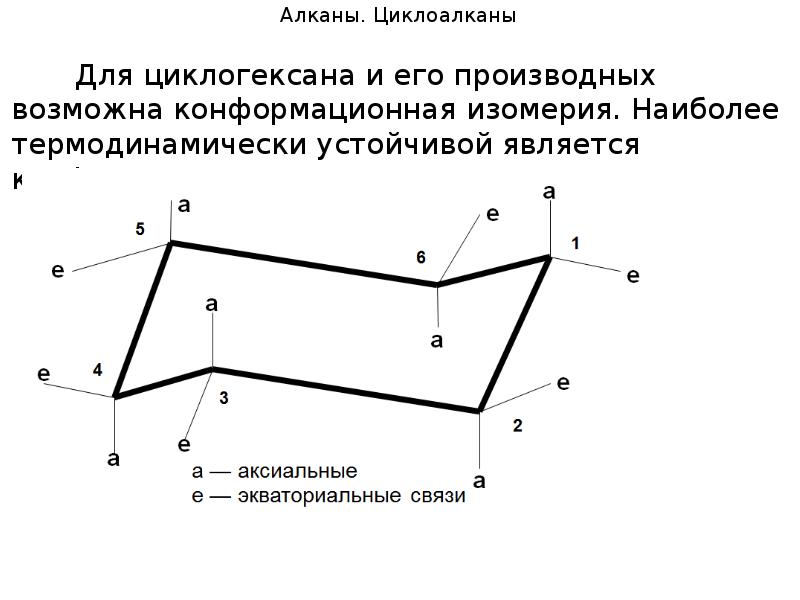
- 93. Алканы. Циклоалканы
- 94. Кислотность органических соединений Кислотно-основные свойства органических веществ рассматривают, основываясь на
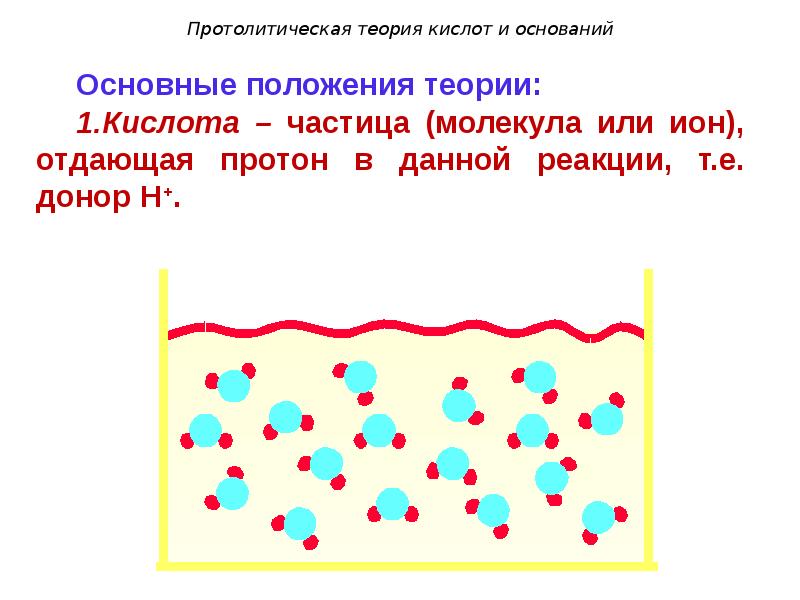
- 95. Протолитическая теория кислот и оснований
- 96. Основные положения теории:
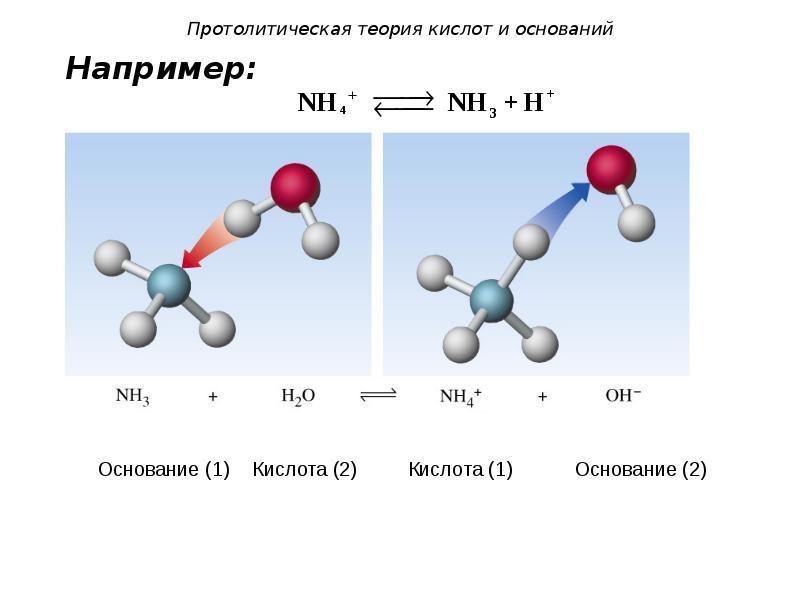
- 97. Протолитическая теория кислот и оснований
- 98. Протолитическая теория кислот и оснований
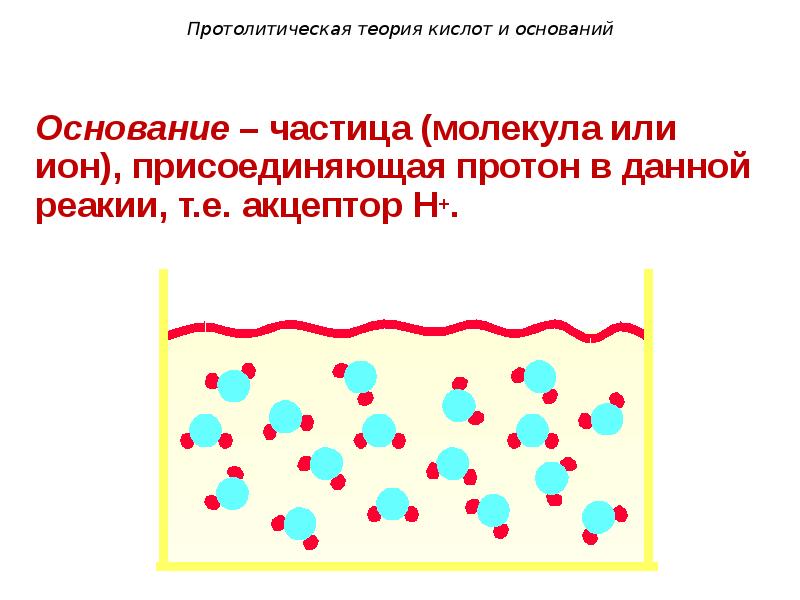
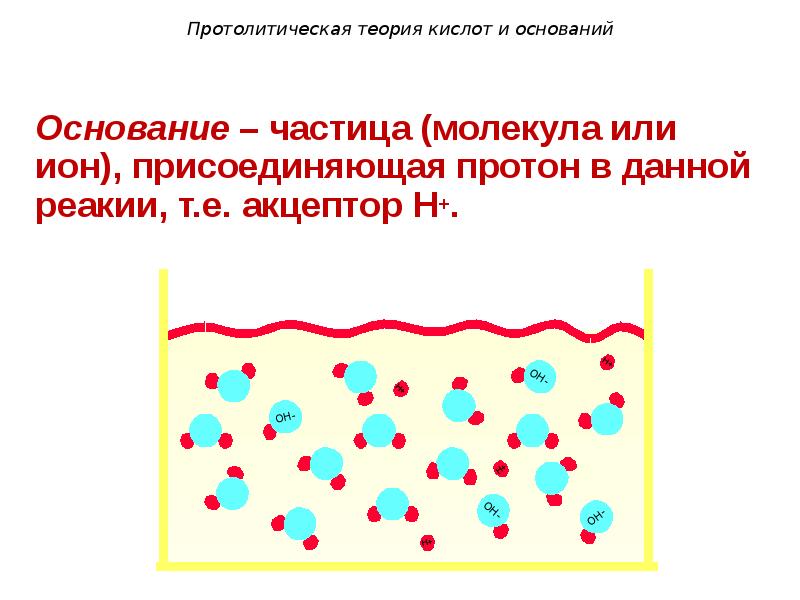
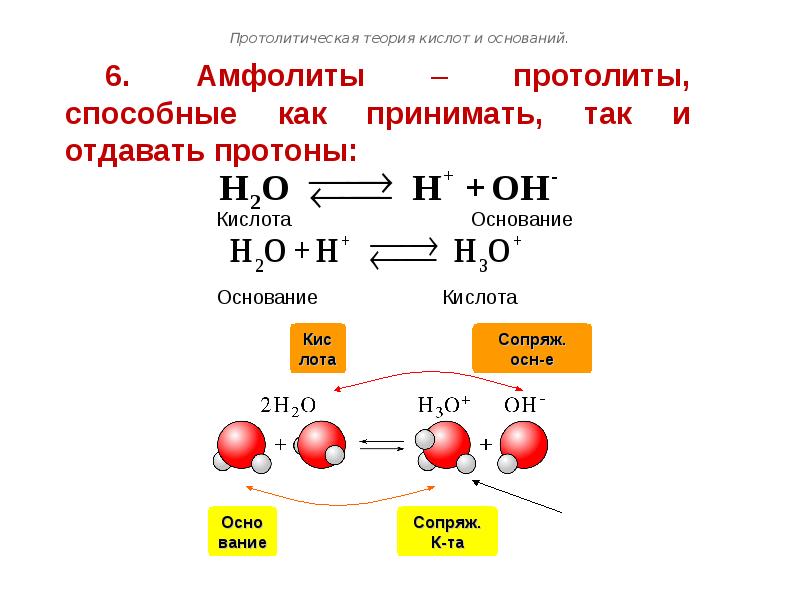
- 99. Протолитическая теория кислот и оснований 2. Основание – частица (молекула или
- 100. Протолитическая теория кислот и оснований
- 101. Протолитическая теория кислот и оснований
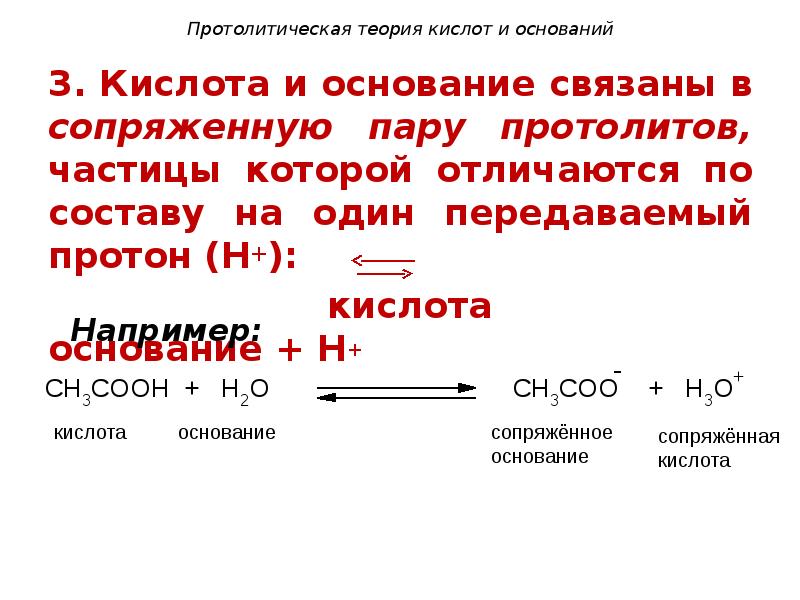
- 102. Протолитическая теория кислот и оснований 3. Кислота и основание связаны в
- 103. Протолитическая теория кислот и оснований
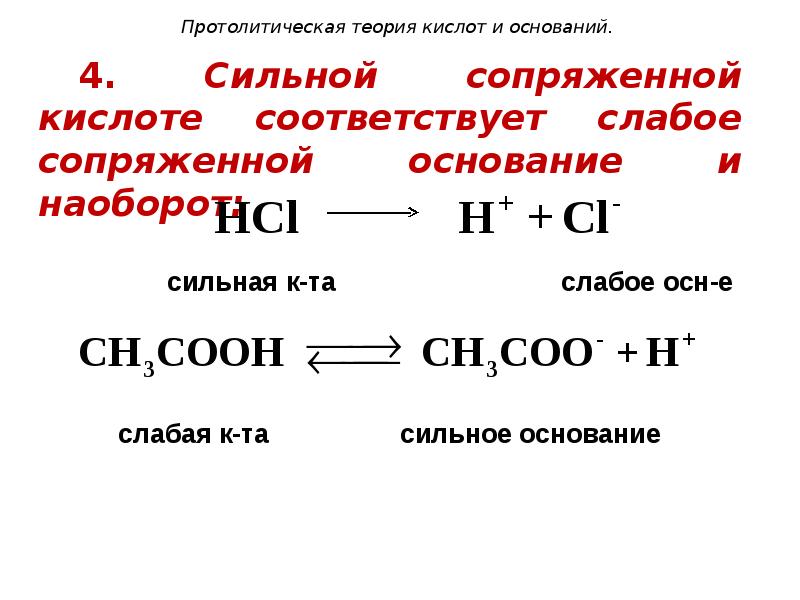
- 104. Протолитическая теория кислот и оснований. 4. Сильной сопряженной кислоте соответствует слабое
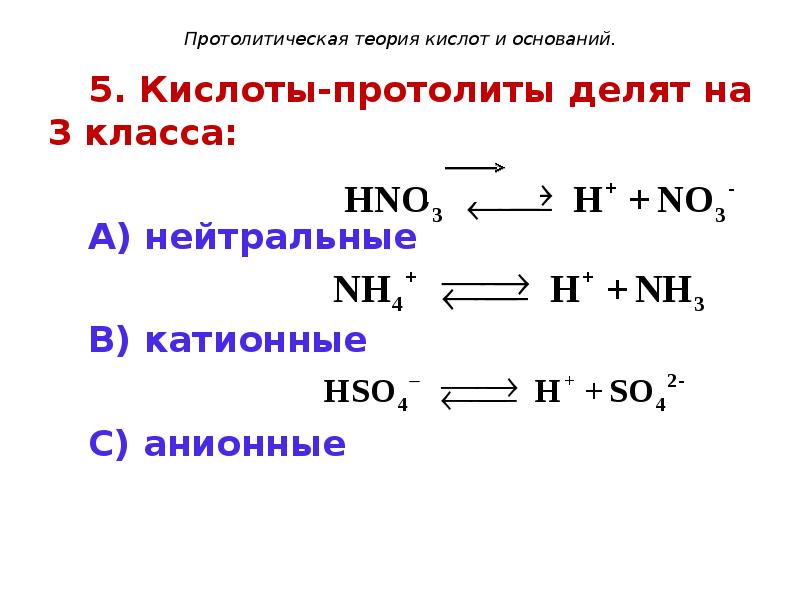
- 105. Протолитическая теория кислот и оснований. 5. Кислоты-протолиты делят на 3 класса:
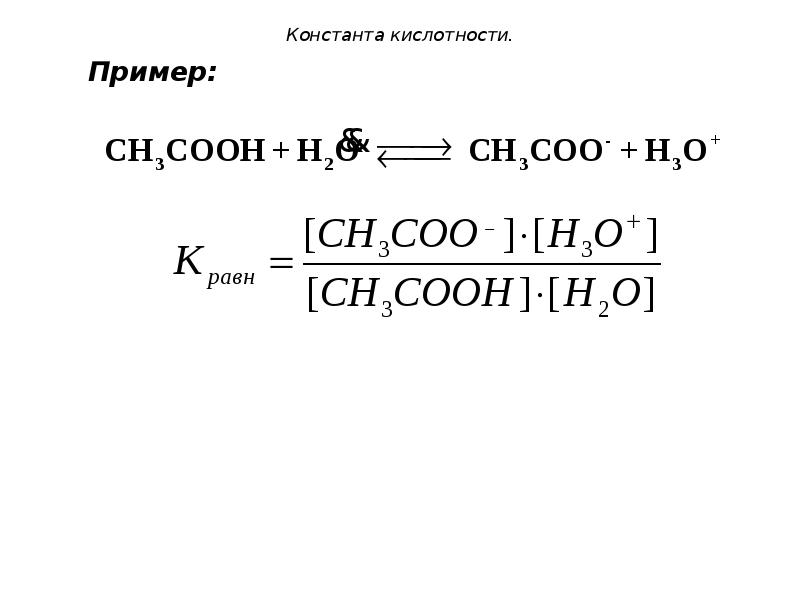
- 108. Константа кислотности. 7. Количественно сила кислот-протолитов оценивается величиной константы кислотности (Ка).
- 109. Константа кислотности. Пример:
- 110. Константа кислотности. Перемножим обе части уравнения на постоянную величину молярной концентрации
- 111. Протолитическая теория кислот и оснований.
- 112. Кислотность органических соединений Большинство органических соединений можно рассматривать как кислоты,
- 113. Кислотность органических соединений Формулы и названия веществ рКа
- 114. Кислотность органических соединений На стабильность аниона оказывают влияние следующие факторы: 1.
- 115. Кислотность органических соединений Поскольку кислород является более электроотрицательным элементом, то
- 116. Кислотность органических соединений б) поляризуемость элемента в кислотном центре. Сравним кислотные
- 117. Кислотность органических соединений Благодаря большему радиусу и более высокой поляризуемости
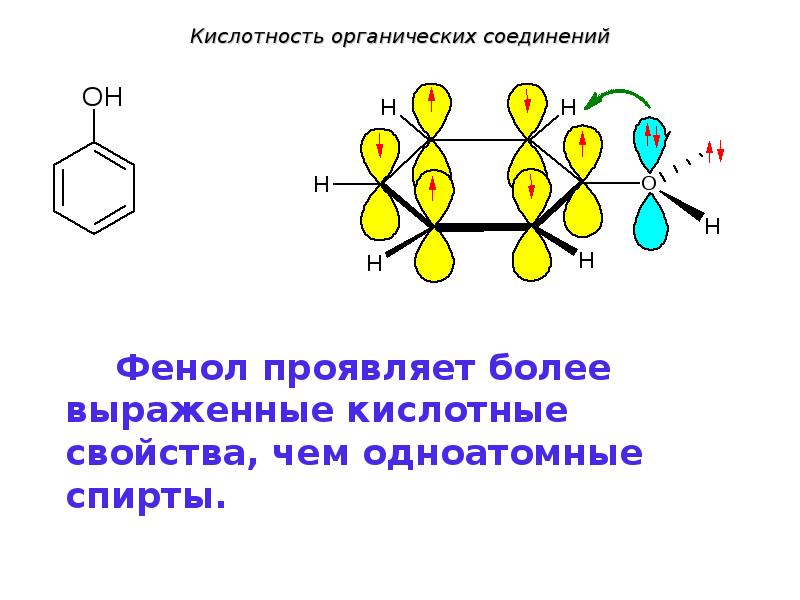
- 118. Кислотность органических соединений 2.Влияние сопряжения на стабильность аниона Пример: Этанол СН3–СН2–ОН
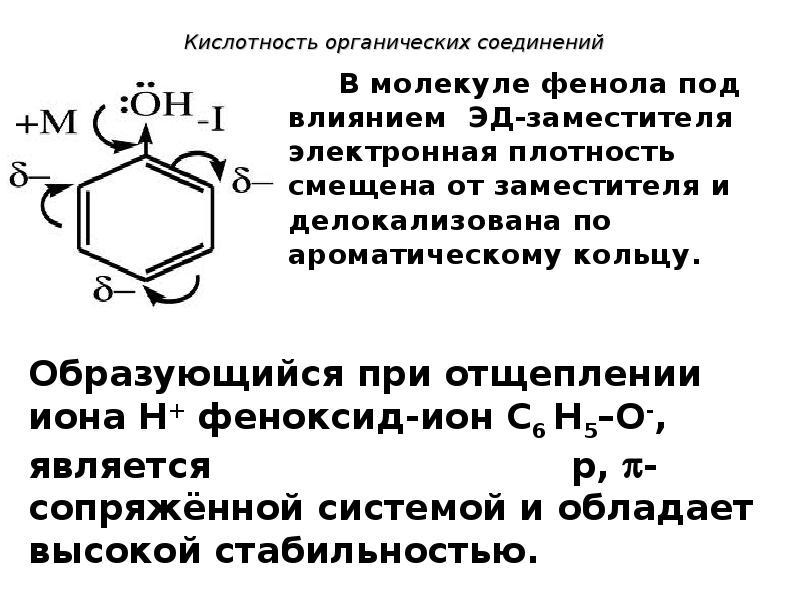
- 119. Кислотность органических соединений В молекуле фенола под влиянием ЭД-заместителя электронная
- 120. Кислотность органических соединений
- 121. Кислотность органических соединений 3. Влияние заместителей на стабильность аниона Пример:
- 122. Кислотность органических соединений 4. Влияние растворителя на стабильность аниона В
- 123. Спасибо за Ваше внимание! Спасибо за Ваше внимание!
- 124. Скачать презентацию









































Слайды и текст этой презентации
Скачать презентацию на тему Изомерия. Кислотность органических соединений можно ниже:
Похожие презентации





























