Изотопы. История открытия. Изотопы водорода презентация
Содержание
- 2. Цель урока Ввести понятие изотопы Тип урока – изучение нового материала
- 3. Изотопы Это разновидности данного химического элемента, различающиеся по массе атомных ядер.
- 4. История открытия изотопов Первое доказательство того, что вещества, имеющие одинаковое химическое
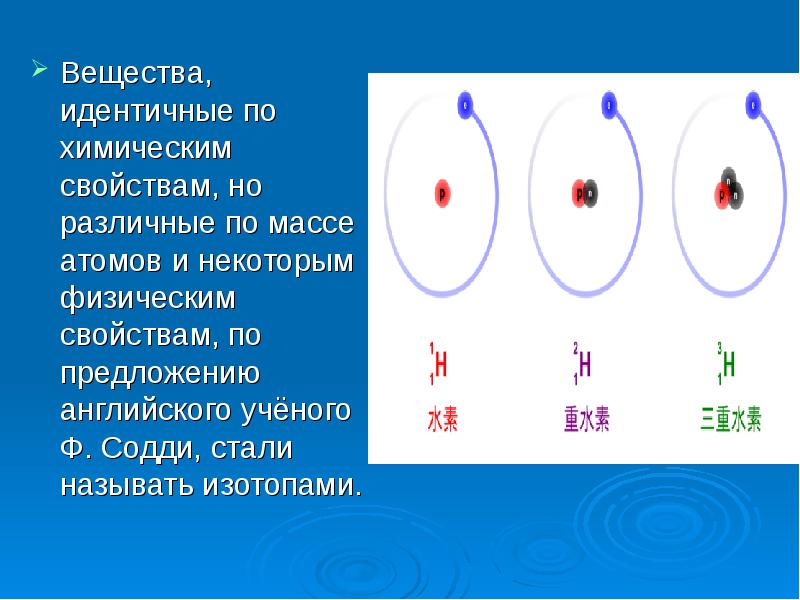
- 5. Вещества, идентичные по химическим свойствам, но различные по массе атомов и
- 6. Изотопы водорода Водород встречается в виде трёх изотопов, которые имеют индивидуальные
- 7. Изотопы водорода 3 Н — тритий (T) радиоактивный). Изотоп водорода
- 8. изотопы находятся в одном и том же месте (в одной клетке)
- 9. Радиоактивные изотопы — изотопы, ядра которых нестабильны и испытывают радиоактивный распад.
- 10. Скачать презентацию








Слайды и текст этой презентации
Скачать презентацию на тему Изотопы. История открытия. Изотопы водорода можно ниже:
Похожие презентации





























