Кислородные соединения азота презентация
Содержание
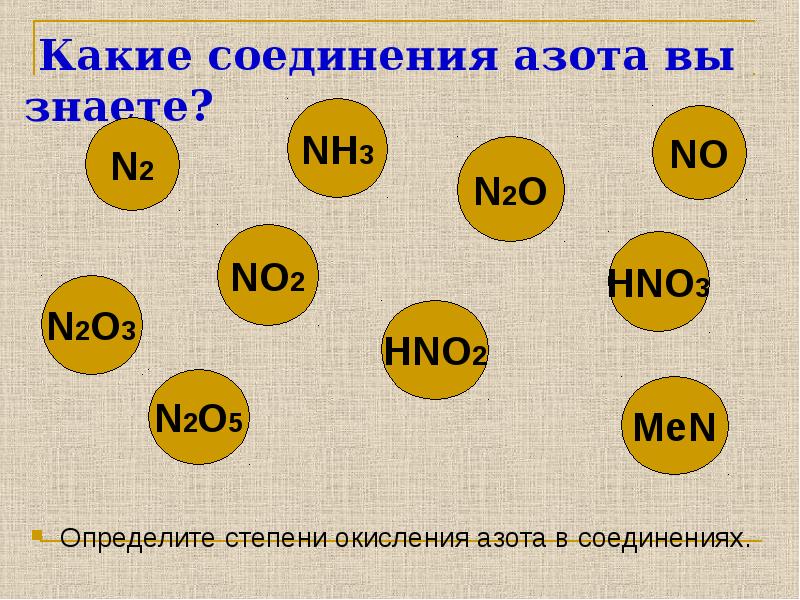
- 2. Какие соединения азота вы знаете? Определите степени окисления азота в соединениях.
- 3. Оксидов у азота – пять. И нам давно пора уж знать,
- 4. Оксид азота (I) монооксид диазота «веселящий газ» Бесцветный газ со слабым
- 5. Оксид азота (II) – монооксид азота Легко окисляется кислородом воздуха до
- 6. Жидкость темно-синего цвета. Кислотный оксид. Получают охлаждением смеси оксидов азота (II)
- 7. Оксид азота (IV) – диоксид азота, «бурый газ», «лисий хвост» Газ
- 8. Оксид азота (V) Кислотный оксид. Белое твердое вещество, хорошо растворимое в
- 9. HNO2 HNO3 Азотистая кислота Азотная кислота
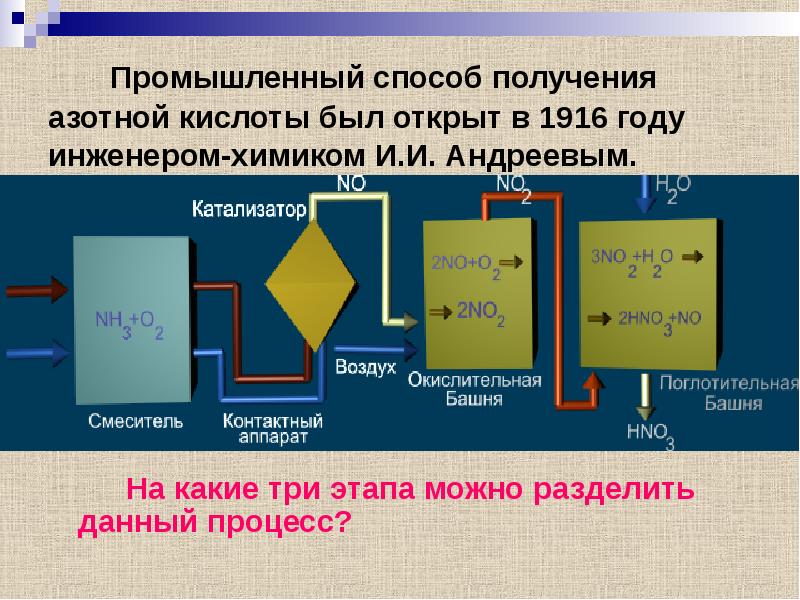
- 10. Промышленный способ получения азотной кислоты был открыт в 1916 году инженером-химиком
- 11. Скачать презентацию








Слайды и текст этой презентации
Похожие презентации





























