Кислоты и основания. (Лекция 16) презентация
Содержание
- 2. Инь и Ян химии
- 3. Теория электролитической диссоциации: недостатки Применимо только к водным растворам, исключая: а)
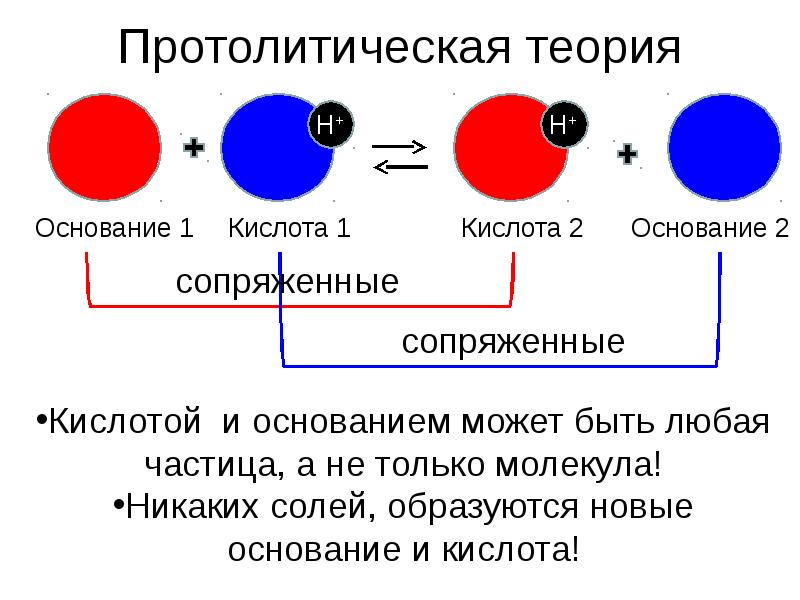
- 4. Протолитическая теория (1923) Кислота – донор протона, основание – акцептор протона.
- 5. Протолитическая теория
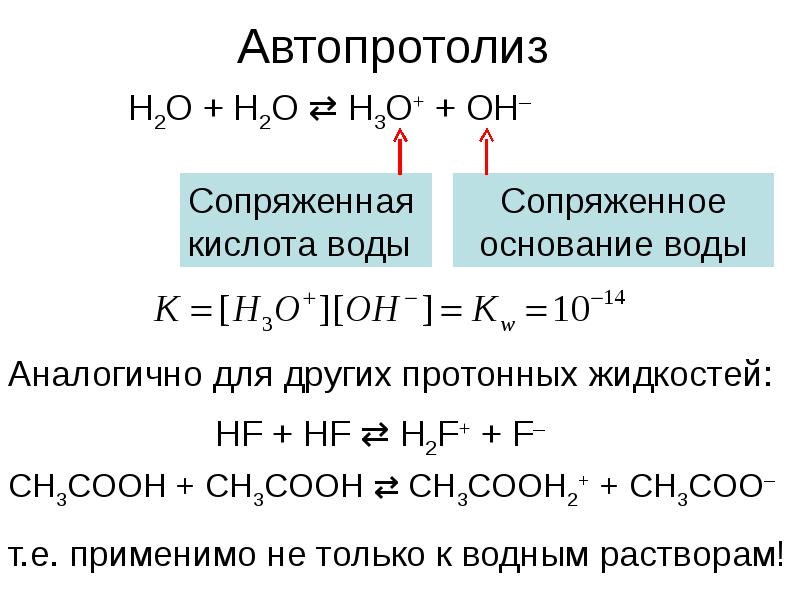
- 6. Автопротолиз
- 7. Константы ионизации для сопряженных кислот и оснований
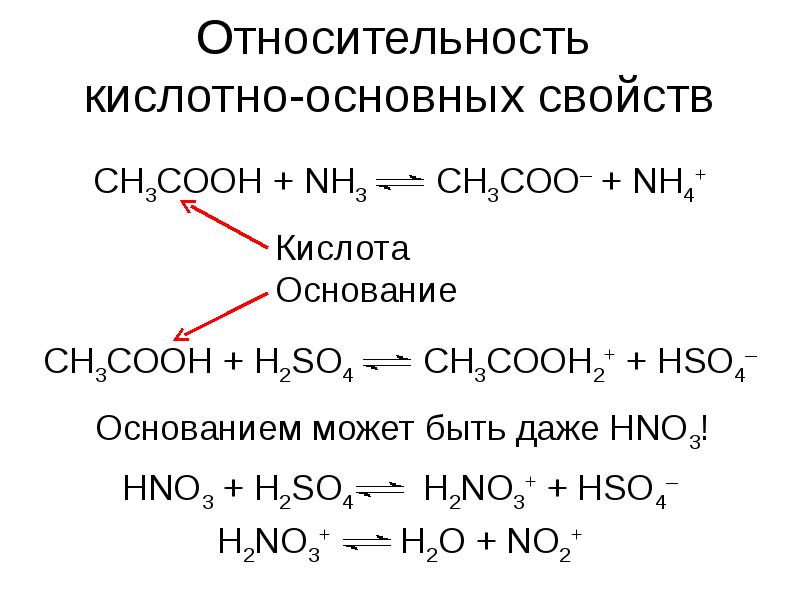
- 8. Относительность кислотно-основных свойств
- 9. Суперкислоты (1968)
- 10. Ограничения протолитической теории Неприменима к реакциям без растворителя; Неприменима к полностью
- 11. Что за вещество? Тяжелая жидкость с едким, раздражающим запахом; «Дымит» на
- 12. Электронная теория (1923)
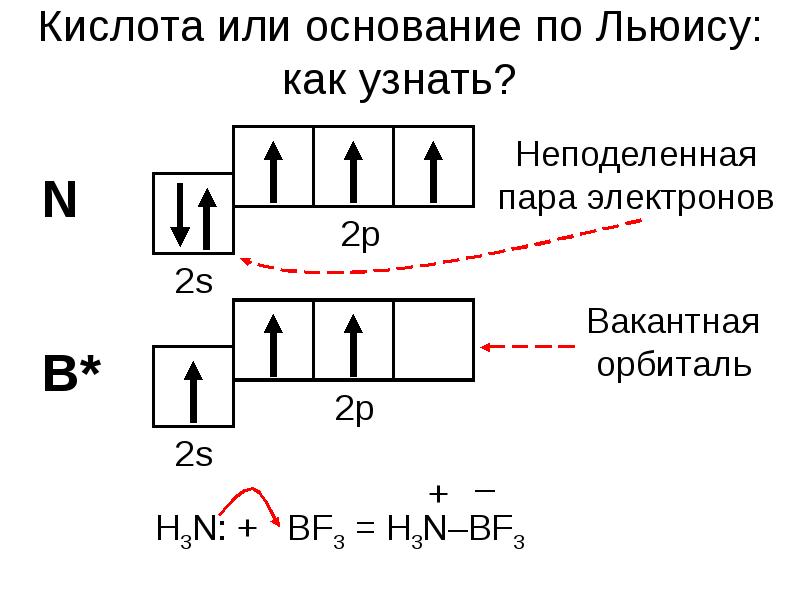
- 13. Кислота или основание по Льюису: как узнать?
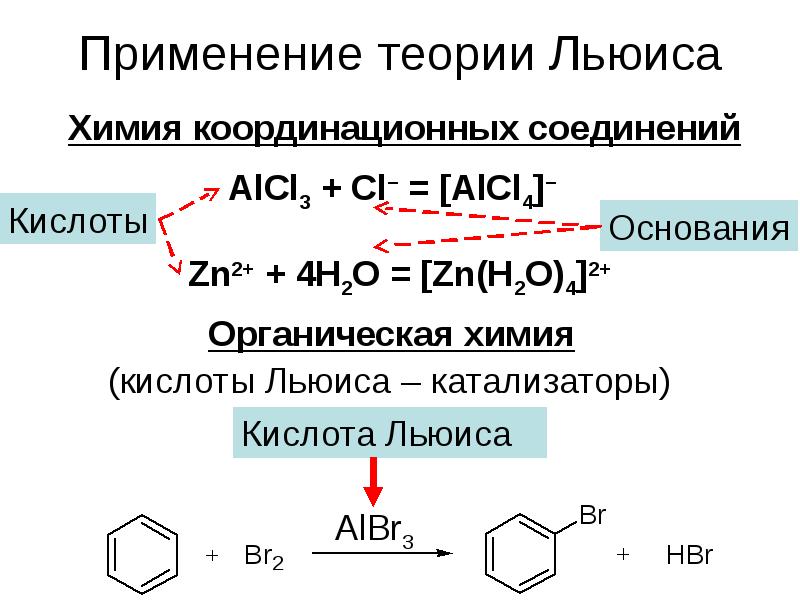
- 14. Применение теории Льюиса
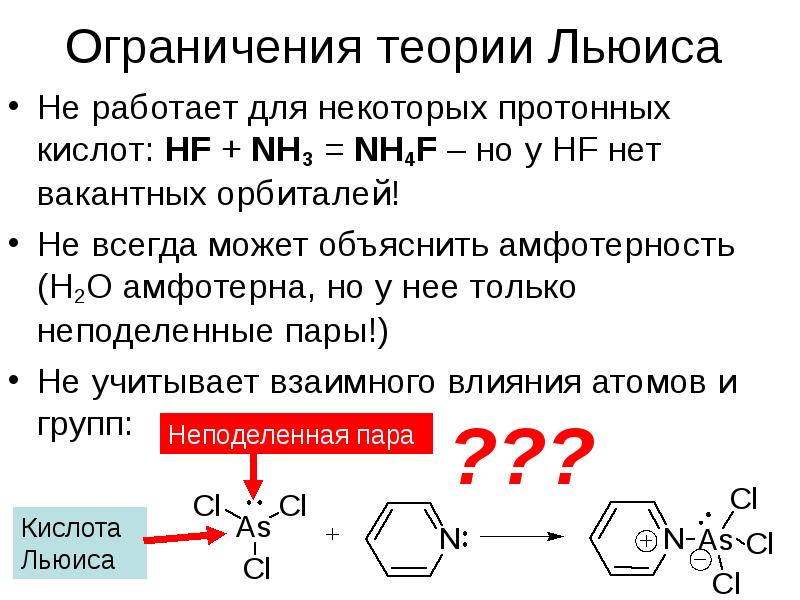
- 15. Ограничения теории Льюиса Не работает для некоторых протонных кислот: HF +
- 16. Теория реакций в расплаве Лукса – Флуда Применяется для реакций между
- 17. Теория «ониевых солей» Ганча Главный признак кислотно-основной реакции – солеобразование; То,
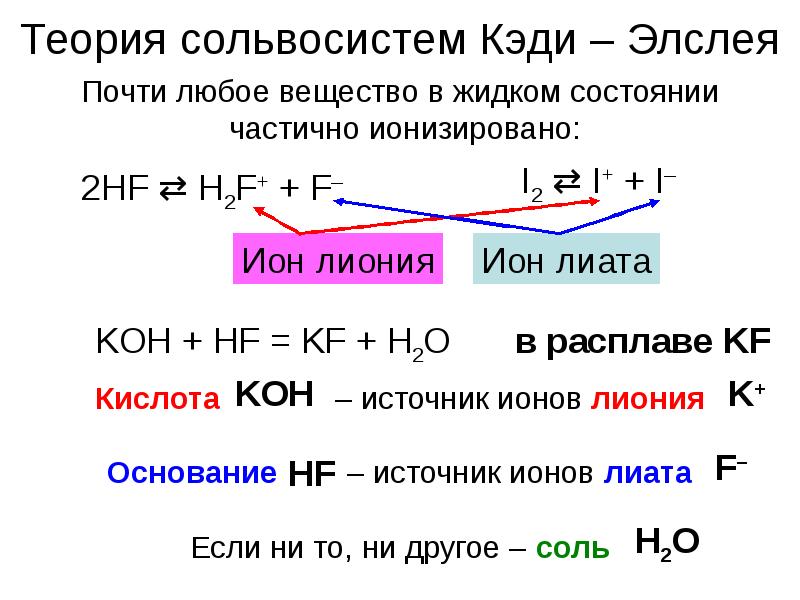
- 18. Теория сольвосистем Кэди – Элслея
- 19. Обобщенная теория кислот и оснований Усановича (1938 г.)
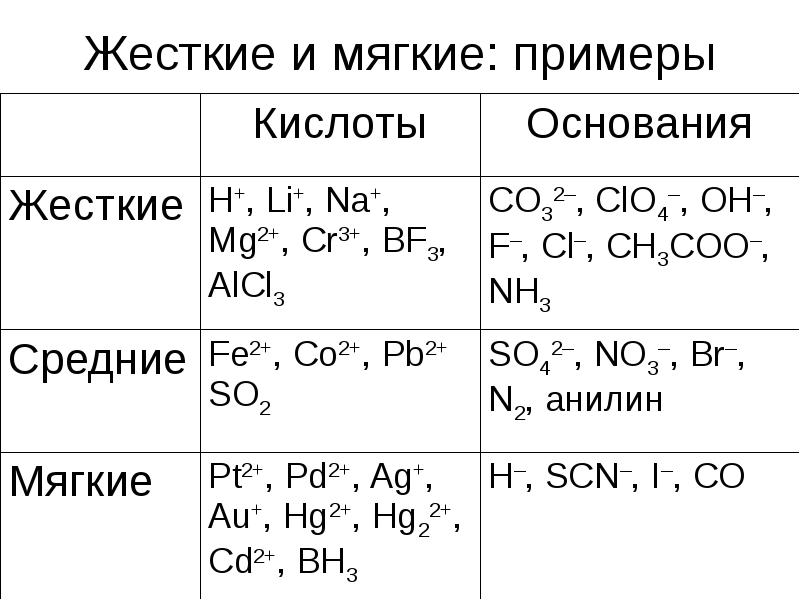
- 20. Теория ЖМКО: жестких и мягких кислот и оснований Пирсона (1963) Маленький
- 21. Жесткие и мягкие: примеры
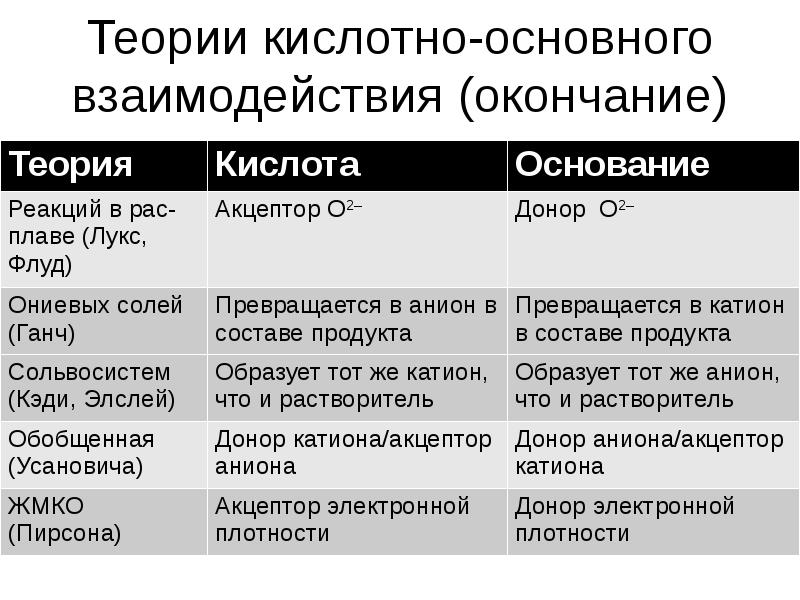
- 22. Теории кислотно-основного взаимодействия
- 23. Теории кислотно-основного взаимодействия (окончание)
- 24. Скачать презентацию













Слайды и текст этой презентации
Похожие презентации





























