Классы неорганических соединений презентация
Содержание
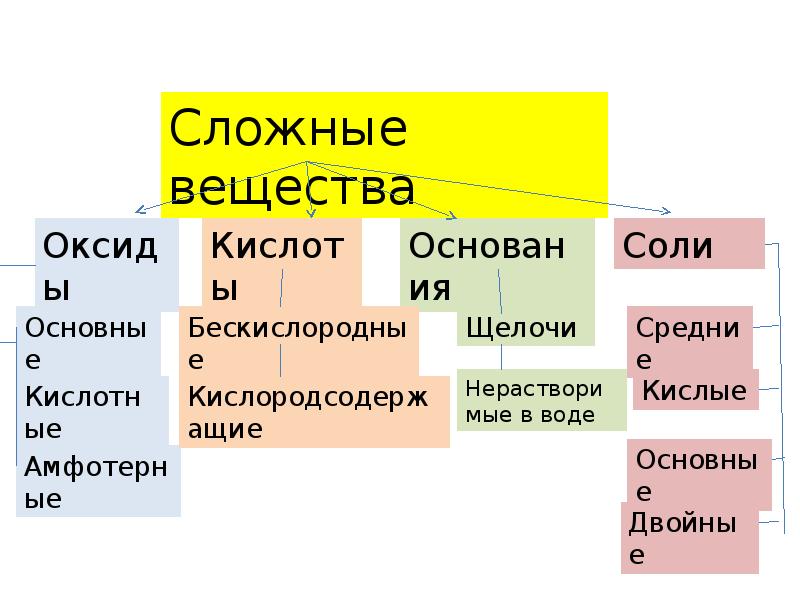
- 3. Вещества, образованные атомами двух элементов, одним из которых является кислород Оксиды
- 4. Вещества, молекулы которых состоят из одного или нескольких атомов водорода, способных
- 5. Вещества, образованные атомами металлов и гидроксогруппами. Основания
- 6. Вещества, образованные атомами металлов и кислотными остатками. Соли
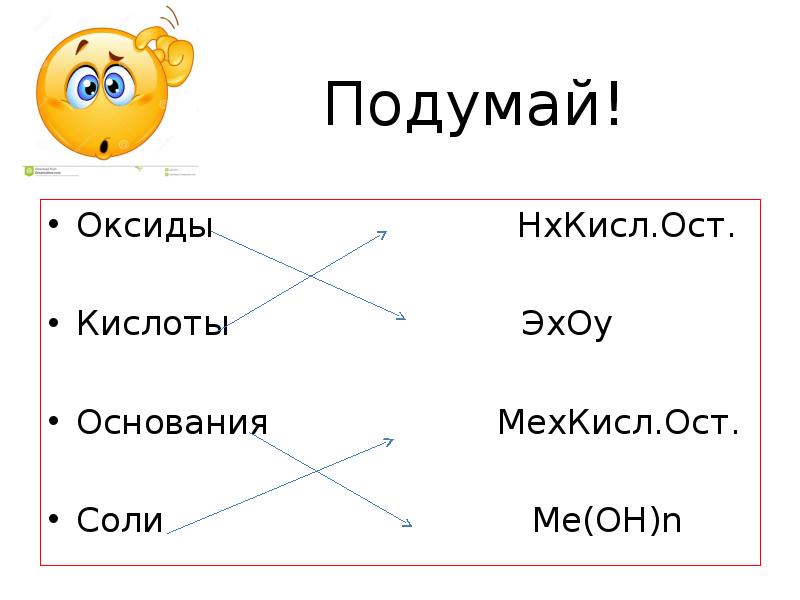
- 7. Подумай! Оксиды HxКисл.Ост. Кислоты
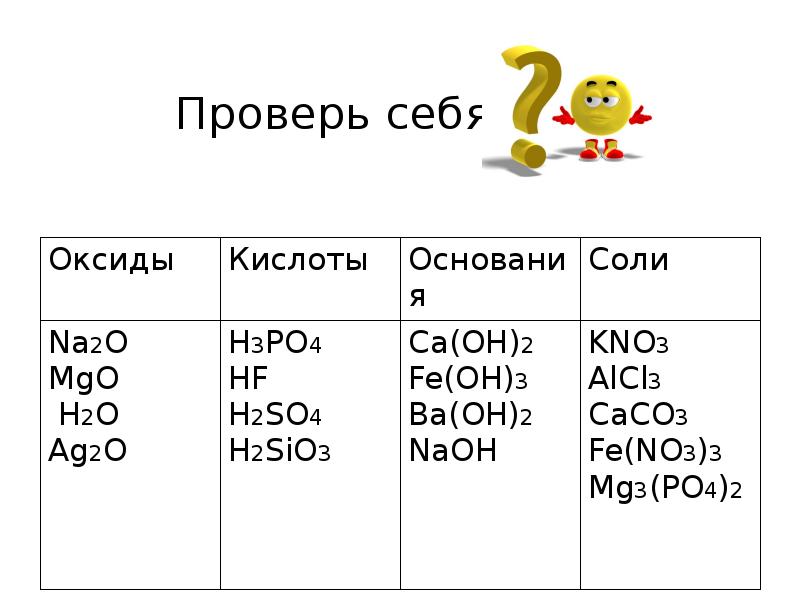
- 8. Даны вещества: Na2O, H3PO4, KNO3, Ca(OH)2, AlCl3, MgO, Fe(OH)3, HF, H2O,
- 9. Проверь себя!
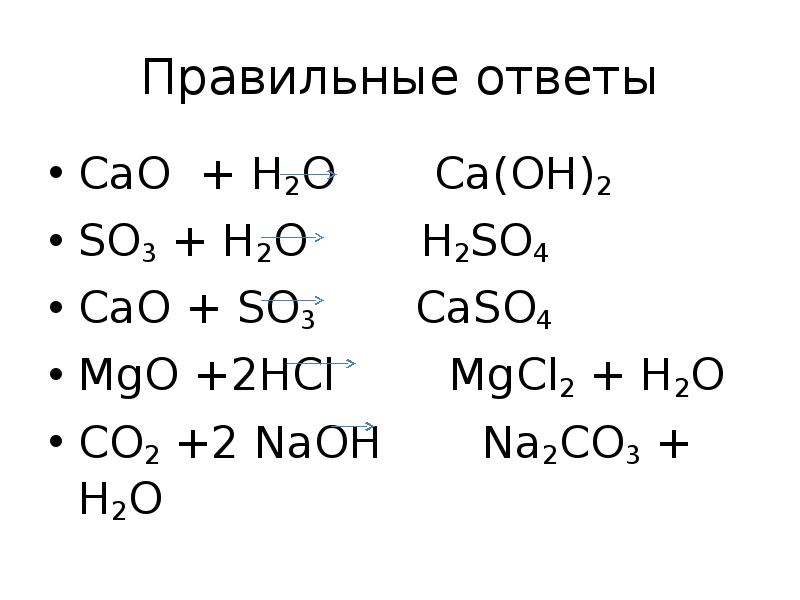
- 11. Закончите уравнения реакции: СаO + H2O SO3 + H2O
- 12. Правильные ответы СаO + H2O Ca(OH)2 SO3 + H2O
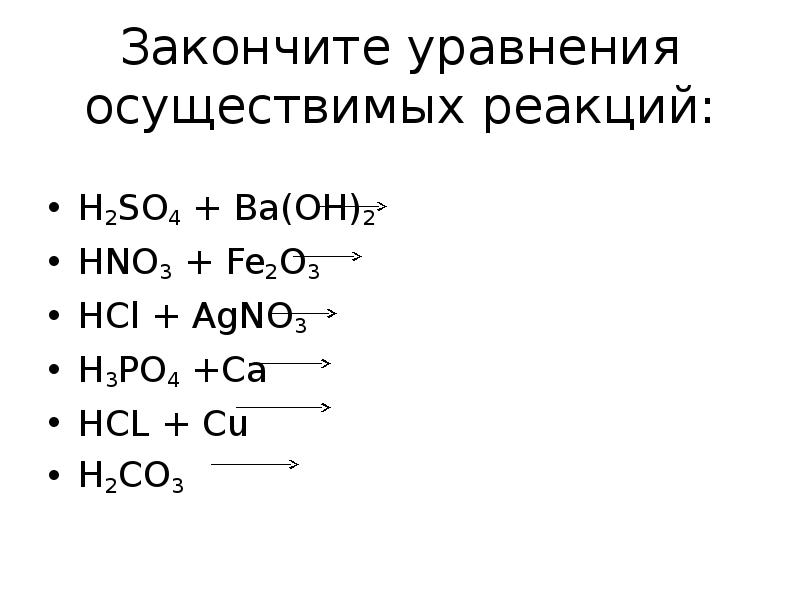
- 13. Закончите уравнения осуществимых реакций: H2SO4 + Ba(OH)2 HNO3 + Fe2O3
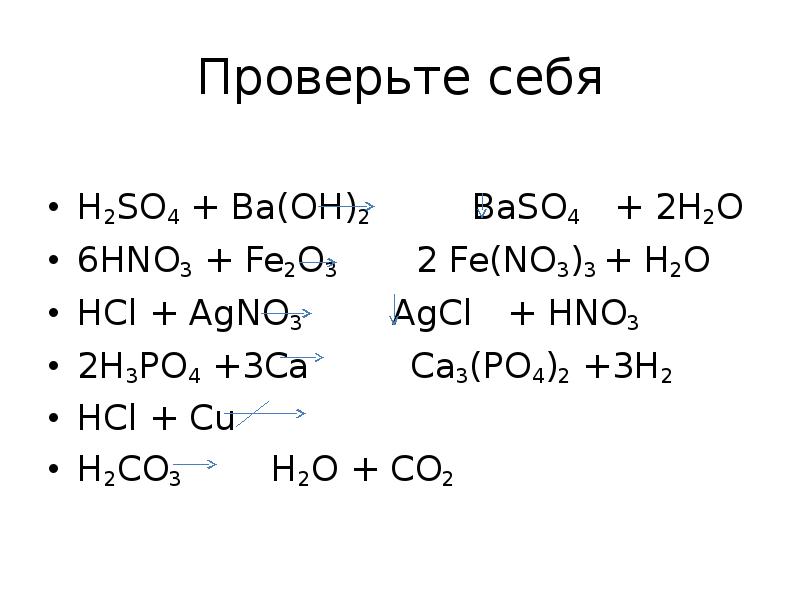
- 14. Проверьте себя H2SO4 + Ba(OH)2 BaSO4 + 2H2O 6HNO3
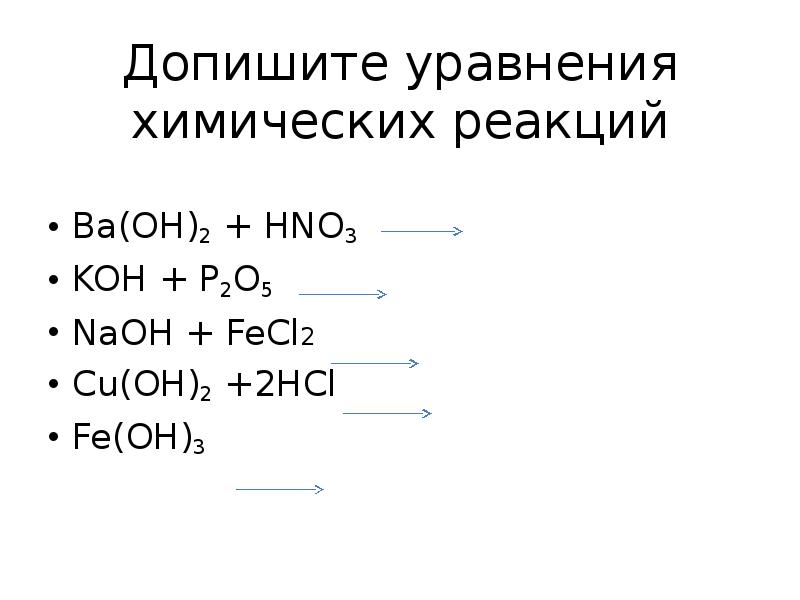
- 15. Допишите уравнения химических реакций Ba(OH)2 + HNO3 KOH + P2O5
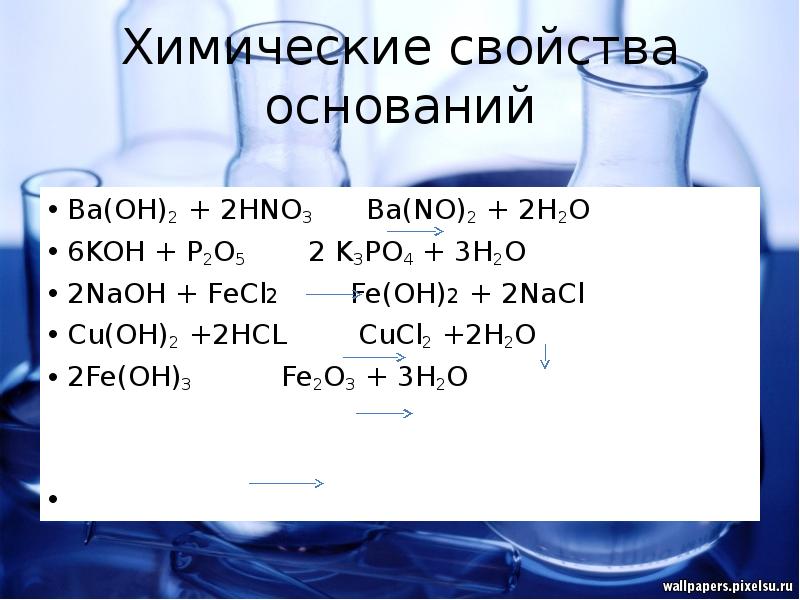
- 16. Химические свойства оснований Ba(OH)2 + 2HNO3 Ba(NO)2 + 2H2O 6KOH
- 17. Химические свойства солей CuSO4 + KOH H2SO4 + BaCl2 CaCl2 +
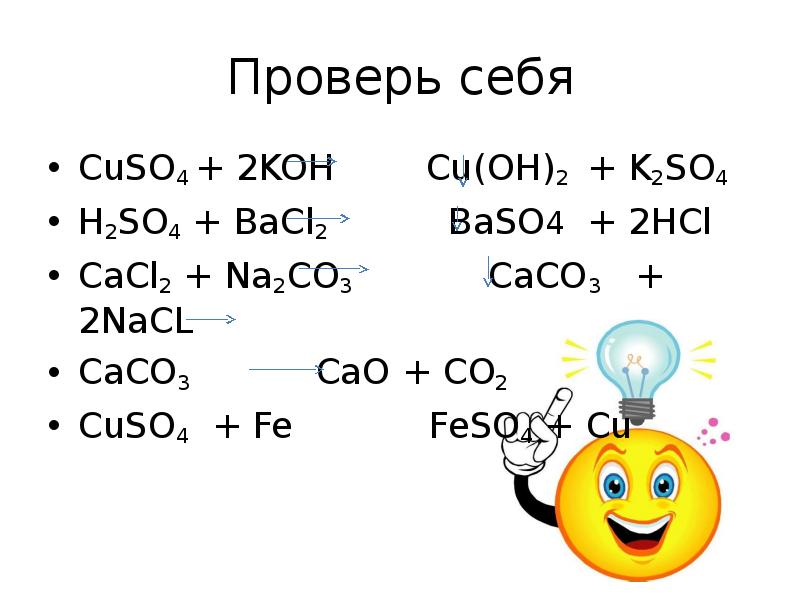
- 18. Проверь себя CuSO4 + 2KOH Cu(OH)2 + K2SO4 H2SO4 +
- 19. ТЕСТ 1) Из предложенного перечня выберите основной оксид а) K2O
- 20. ОТВЕТЫ ТЕСТА 1) А 2) А 3) В 4) Б 5)
- 22. Скачать презентацию












Слайды и текст этой презентации
Похожие презентации





























