Курс лекций по химии презентация
Содержание
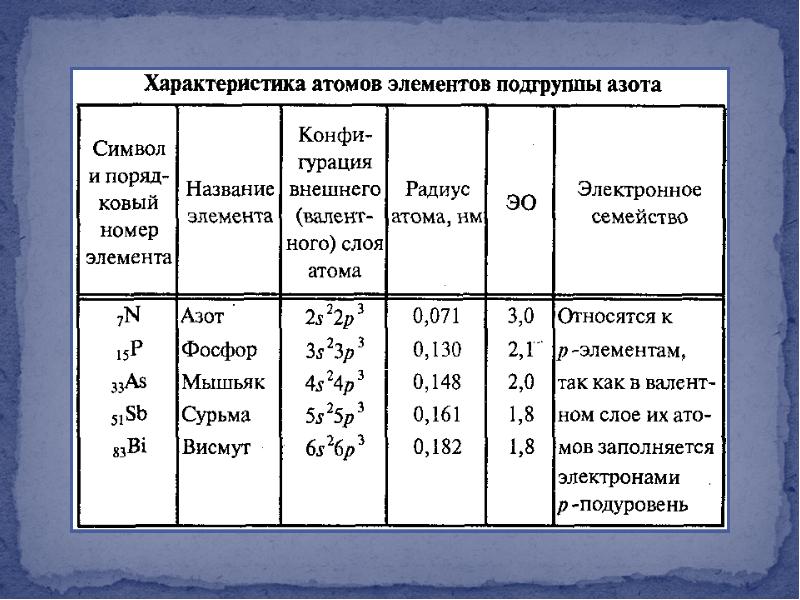
- 2. Общая характеристика элементов подгруппы азота. Азот. Аммиак. Соли аммония. Общая характеристика
- 3. Азот, фосфор и мышьяк – неметаллы Сурьма и висмут металлы Характерная
- 7. Аммиак Фосфин Арсин Стибин Висмутин
- 8. Водные растворы аммиака и фосфина представляют собой слабые основания Водные растворы
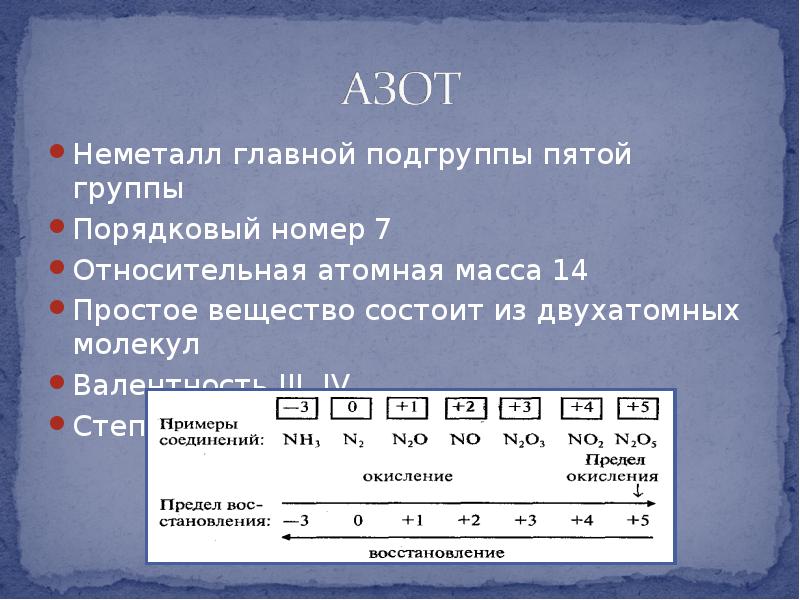
- 9. Неметалл главной подгруппы пятой группы Неметалл главной подгруппы пятой группы Порядковый
- 10. Способы получения Способы получения Промышленные Лабораторные
- 11. Физические свойства Физические свойства Химические свойства Азот малоактивное вещество Энергия связи
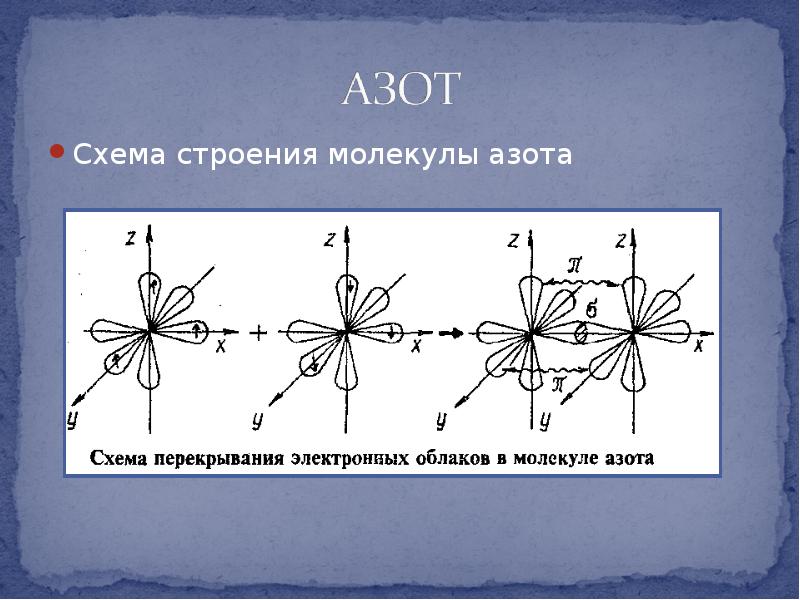
- 12. Схема строения молекулы азота Схема строения молекулы азота
- 13. В химических реакциях азот может быть как окислителем, так и восстановителем
- 14. Азот как восстановитель Азот как восстановитель
- 15. Получение В промышленности Лабораторные способы
- 16. Физические свойства Физические свойства Химические свойства Атом азота в аммиаке имеет
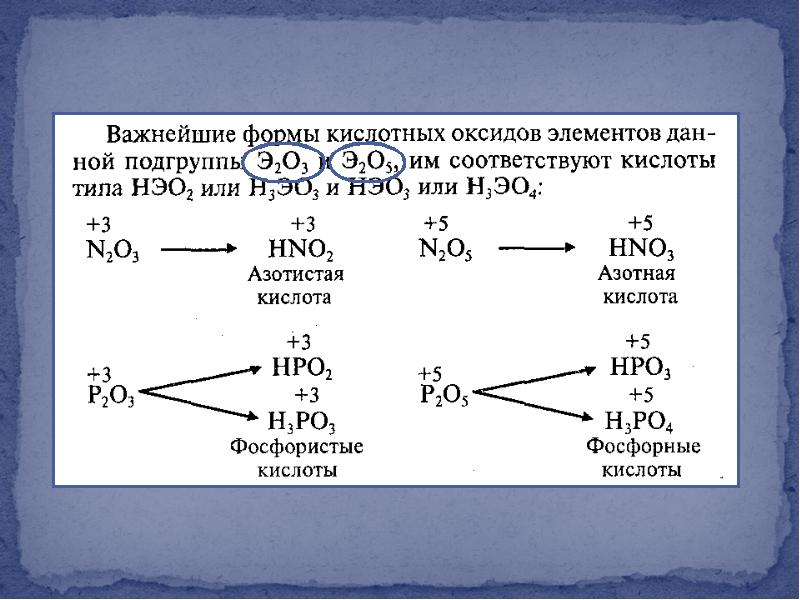
- 17. Кислотно-основные свойства Кислотно-основные свойства
- 19. Окислительно-восстановительные свойства Окислительно-восстановительные свойства
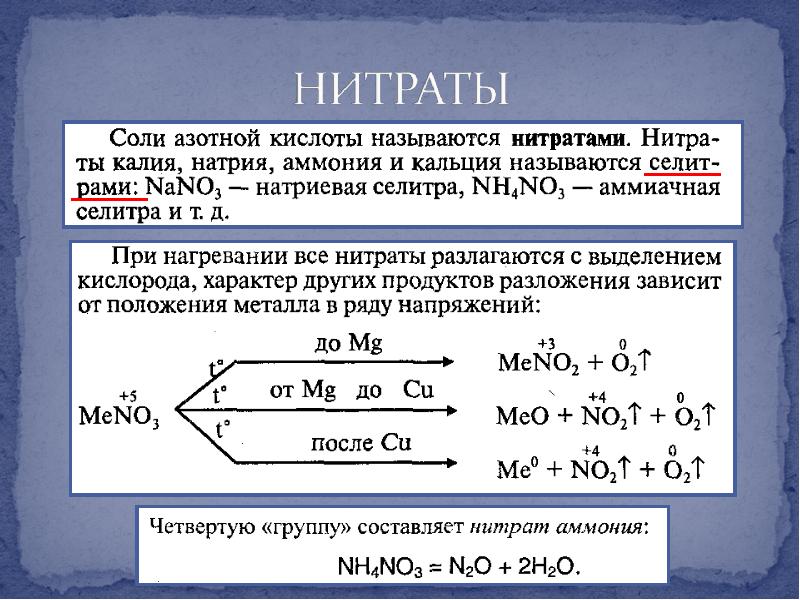
- 20. Все соли аммония хорошо растворимы в воде Имеют общие свойства солей
- 21. Термическое разложение солей аммония Термическое разложение солей аммония
- 22. Бесцветный газ Без запаха Малорастворим в воде Образуется при сильных электрических
- 23. Бесцветный газ Со слабым запахом и сладковатым вкусом Хорошо растворим в
- 25. Ядовитый газ Бурого цвета Хорошо растворим в воде Смешанный оксид, которому
- 26. При растворении в щелочах образуются две соли: При растворении в щелочах
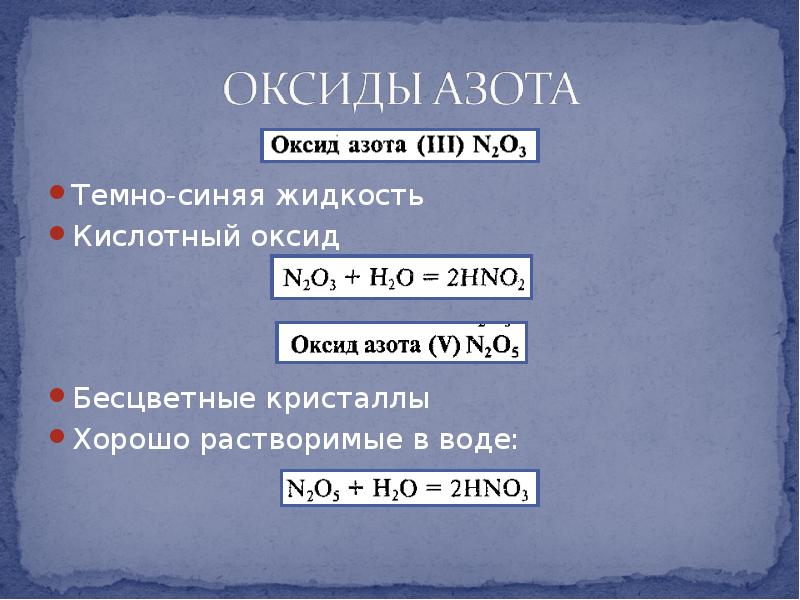
- 27. Темно-синяя жидкость Кислотный оксид Бесцветные кристаллы Хорошо растворимые в воде:
- 28. Физические свойства Физические свойства Бесцветная жидкость Имеет резкий запах Легко испаряется
- 29. Химические свойства Химические свойства Кислотно-основные свойства
- 30. Окислительно-восстановительные свойства Окислительно-восстановительные свойства Азотная кислота – один из сильнейших окислителей
- 35. Получение Получение В промышленности – процесс идет в три стадии
- 36. В лаборатории В лаборатории
- 39. Характерные степени окисления -3 0 +3 +5
- 40. Получение Получение
- 41. Физические свойства Физические свойства Несколько аллотропных модификаций
- 43. Химические свойства Химические свойства Окислительно-восстановительные свойства
- 48. Получение Получение Физические свойства
- 49. Химические свойства Химические свойства Кислотно-основные свойства
- 50. Окислительно-восстановительные Окислительно-восстановительные
- 51. Бесцветный порошок Без запаха Кислотный оксид При растворении в воде дает
- 52. Выраженные водоотнимающие свойства
- 53. Бесцветное кристаллическое вещество Хорошо растворима в воде Трехосновная, средней силы Диссоциация
- 54. Получение Получение В промышленности – экстракционный метод В лаборатории – окислением
- 56. Гидролиз солей фосфорной кислоты Гидролиз солей фосфорной кислоты
- 57. Скачать презентацию


















































Слайды и текст этой презентации
Похожие презентации





























