Лекция 5. Красные пигменты презентация
Содержание
- 2. Красная охра природный пигмент, цвет придают соединения Fe (III). Красные железоокисные
- 3. Сурик свинцовый смешанный оксид Рb (II) и Рb (IV) 2РbО·РbО2 хорошо
- 4. Киноварь природный минерал или искусственно получаемый сульфид ртути HgS стойка по
- 5. Красные пигменты Свинцовый сурик Киноварь
- 6. Красные пигменты Реальгар (природный минерал состава As4S4) с трудом растворяется в
- 7. Красные пигменты Киноварь, реальгар, и сурьмяная красная, являясь сульфидами, под действием
- 8. Красные пигменты Для перевода в раствор: киноварь растворяют в царской водке
- 9. Красные пигменты: обнаружение Hg2+ К капле раствора, содержащего Hg2+, прибавляют каплю
- 10. Красные пигменты Обнаружение As(V): к капле раствора, содержащего As(V), добавляют
- 11. Красный кадмий твердый раствор сульфида и селенида кадмия CdS·n(CdSe) не растворяется
- 12. Красные пигменты Обнаружение Cd2+: в каплю нейтрального раствора помещают крупинку
- 13. Элементарный Se Медленная Аморфная кристаллизация структура
- 14. Красный хром основной хромат свинца РbСrО4·РbО меняет цвет от светлооранжевого до
- 15. Обнаружение Сr2О72- частицу пигмента растворяют в 30%-ной CH3COOH, в полученный раствор
- 16. Зеленые пигменты
- 17. Глауконит натуральный пигмент K+(Fe3+, Fe2+, Al, Mg)2х 3[Si3(Si,Al)O10]·[OH]2·H2O при прокаливании меняет
- 18. Ярь-медянка ацетаты меди различного химического состава и оттенков: зеленого, зелено-синего, голубого.
- 19. Малахит CuCO3·Cu(OH)2 под действием минеральных кислот вспенивается, выделяя CO2, что отличает
- 20. Медьсодержащие зеленые пигменты Определение пигментов, содержащих медь, предполагает: проведение микрохимических реакций
- 21. Зеленая Шееле Оливенит – основной метаарсенит меди Сu(AsO2)3·nCu(OH)2·mH2O, где n =
- 22. Швейнфуртская зелень арсенит-ацетат меди Сu(СН3СОО)2·ЗСu(AsO2)2 легко растворима в кислотах и
- 23. Медьсодержащие зеленые пигменты Все медные зеленые пигменты при нагревании до высоких
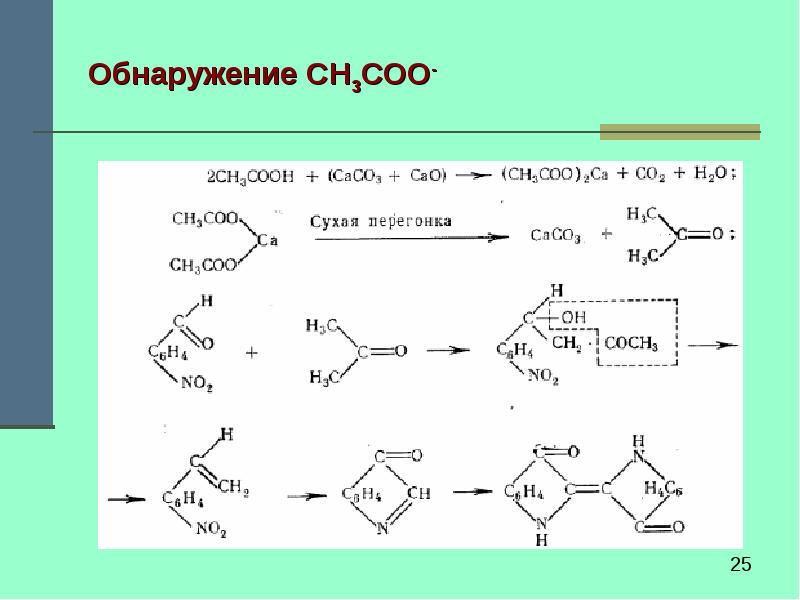
- 24. Зеленые пигменты Обнаружение СН3СОО-: частицу пигмента смешивают со смесью равных
- 25. Обнаружение СН3СОО-
- 26. Зеленый кобальт искусственный пигмент – твердый раствор оксида кобальта Со (II)
- 27. Хромовая зелень оксид хрома Сг2О3 трудно растворим во всех кислотах и
- 28. Скачать презентацию















![Глауконит
натуральный пигмент K+(Fe3+, Fe2+, Al, Mg)2х 3[Si3(Si,Al)O10]·[OH]2·H2O
при прокаливании меняет Глауконит
натуральный пигмент K+(Fe3+, Fe2+, Al, Mg)2х 3[Si3(Si,Al)O10]·[OH]2·H2O
при прокаливании меняет](/documents_3/917d68440fc627595fe23867c89e12d3/img16.jpg)









Слайды и текст этой презентации
Похожие презентации





























