Метод молекулярных орбиталей презентация
Содержание
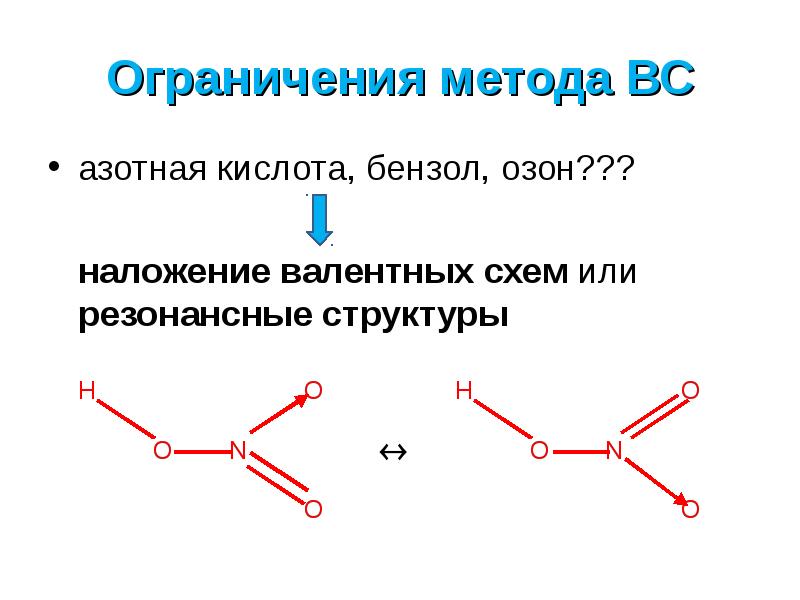
- 2. Ограничения метода ВС азотная кислота, бензол, озон??? наложение валентных схем или
- 3. Метод МО (Малликен, Хунд): молекула – совокупность ядер и электронов,
- 4. ЛКАО (МО)связ = С1(АО1) + С2(АО2) (МО)разр = С3(АО1) – С4(АО2)
- 5. Принципы метода МО 1. Как и в атоме, в молекуле е
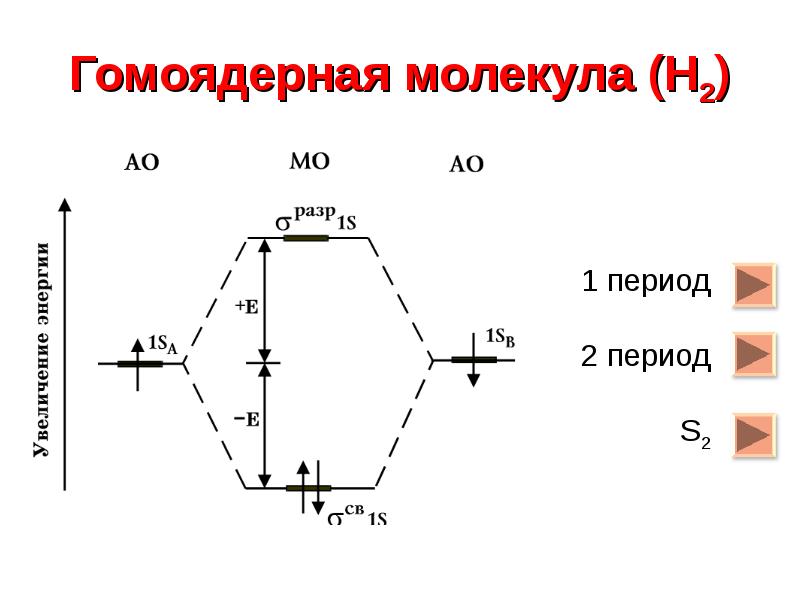
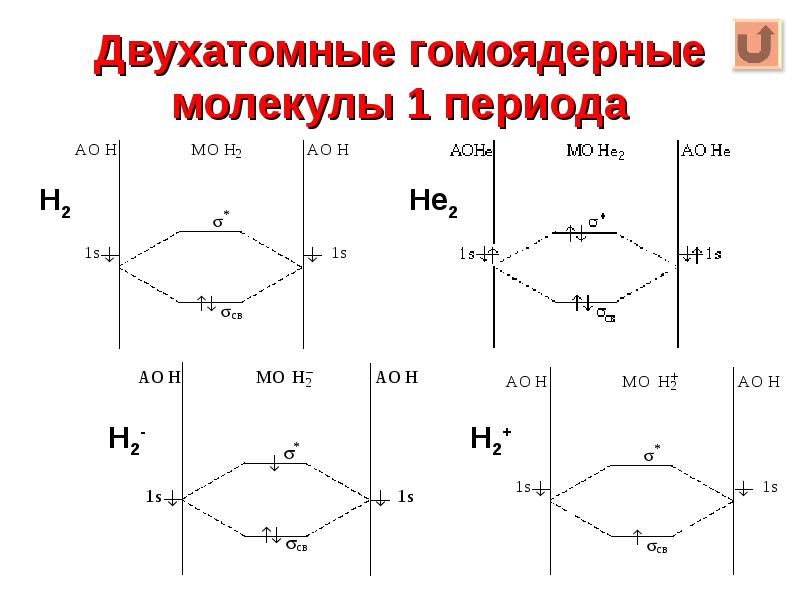
- 6. Гомоядерная молекула (Н2)
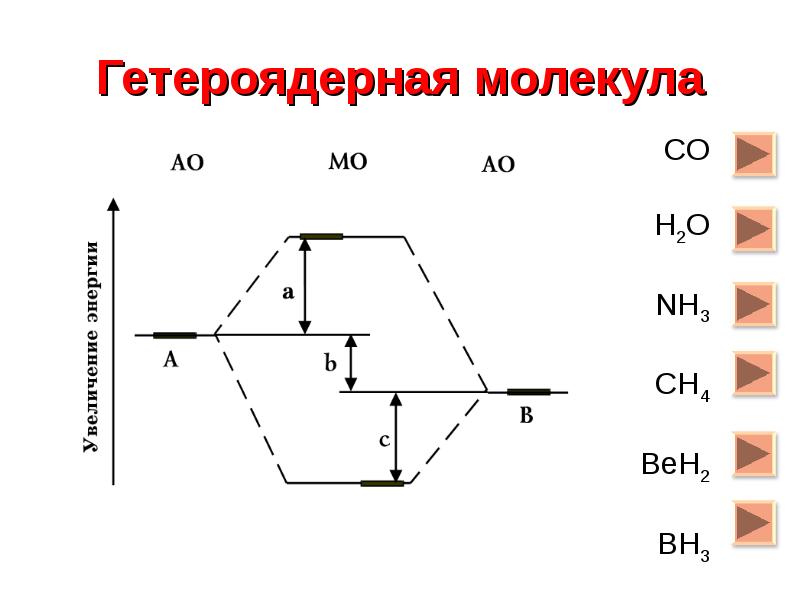
- 7. Гетероядерная молекула
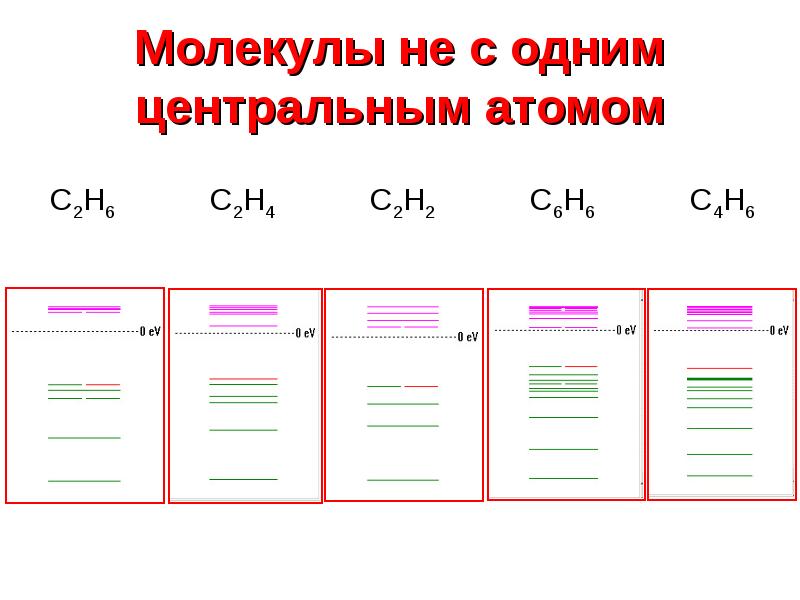
- 8. Молекулы не с одним центральным атомом
- 10. Двухатомные гомоядерные молекулы 1 периода
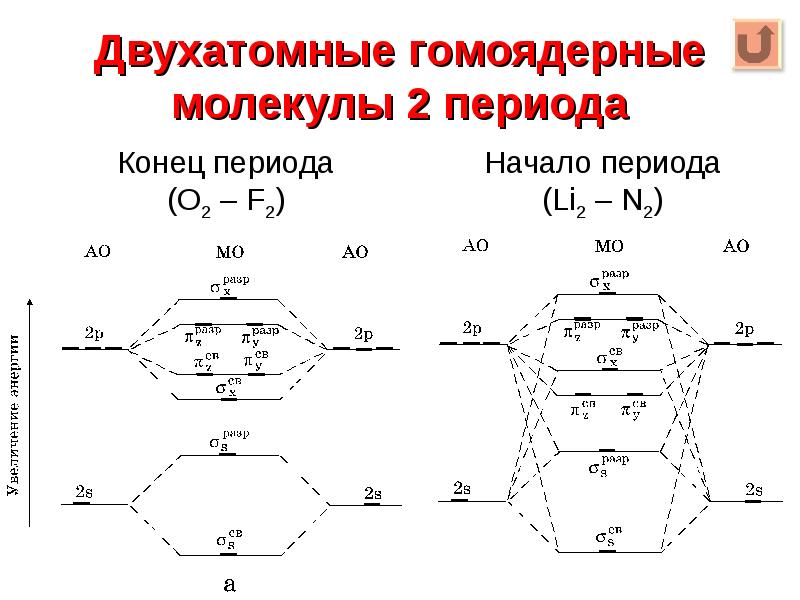
- 11. Двухатомные гомоядерные молекулы 2 периода
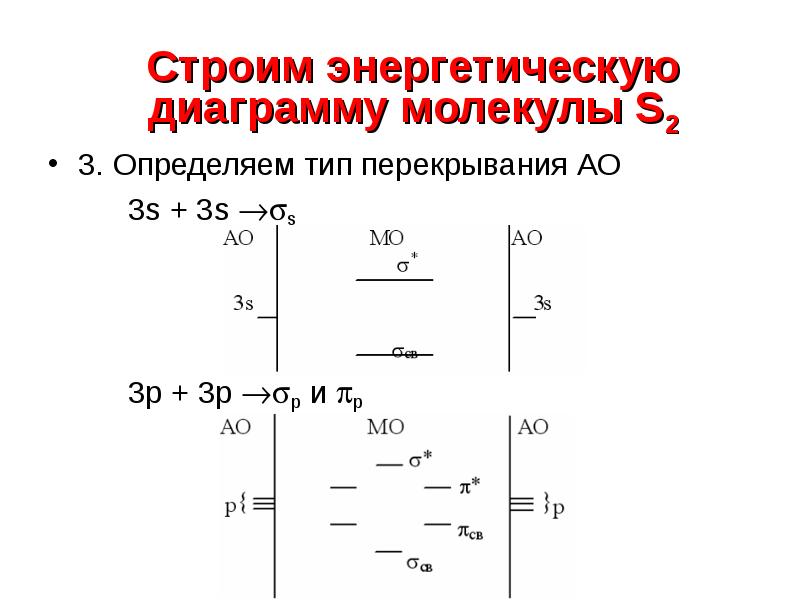
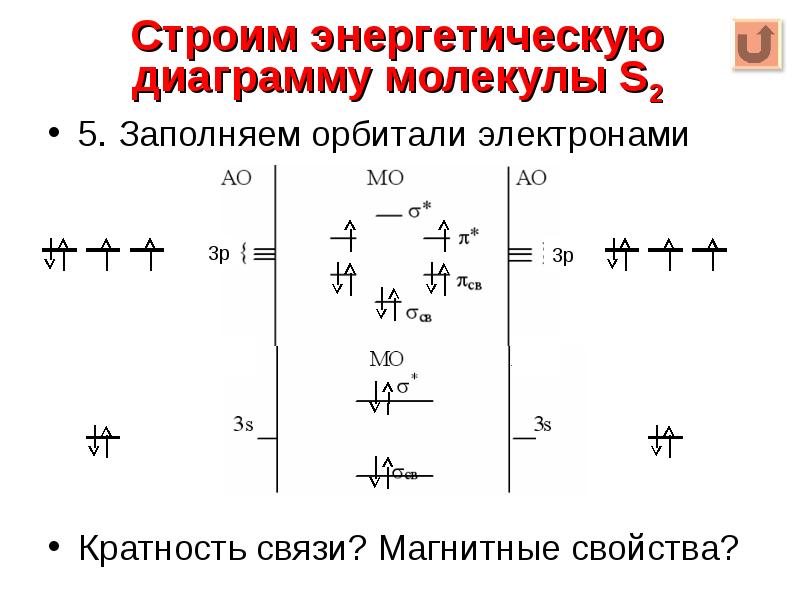
- 12. Строим энергетическую диаграмму молекулы S2 1. Строим АО внешнего уровня 2.
- 13. 3. Определяем тип перекрывания АО 3. Определяем тип перекрывания АО 3s
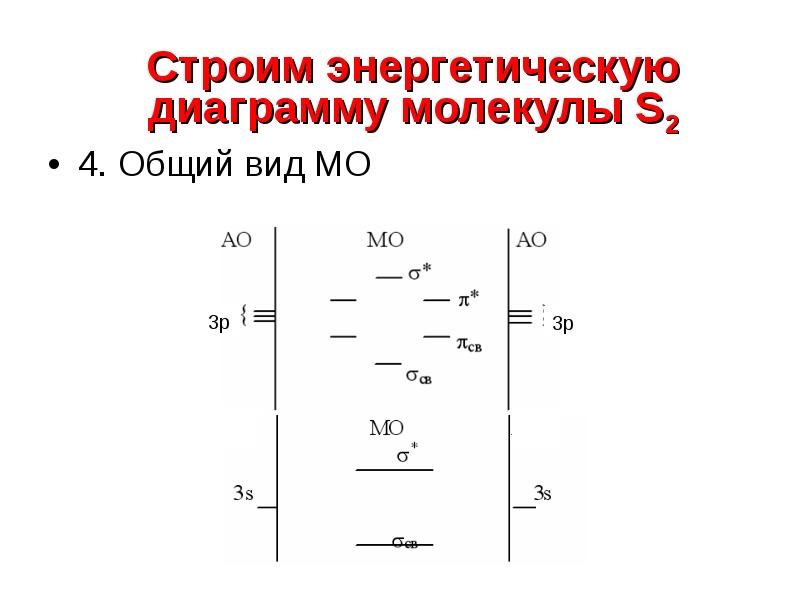
- 14. 4. Общий вид МО 4. Общий вид МО
- 15. 5. Заполняем орбитали электронами 5. Заполняем орбитали электронами Кратность связи? Магнитные
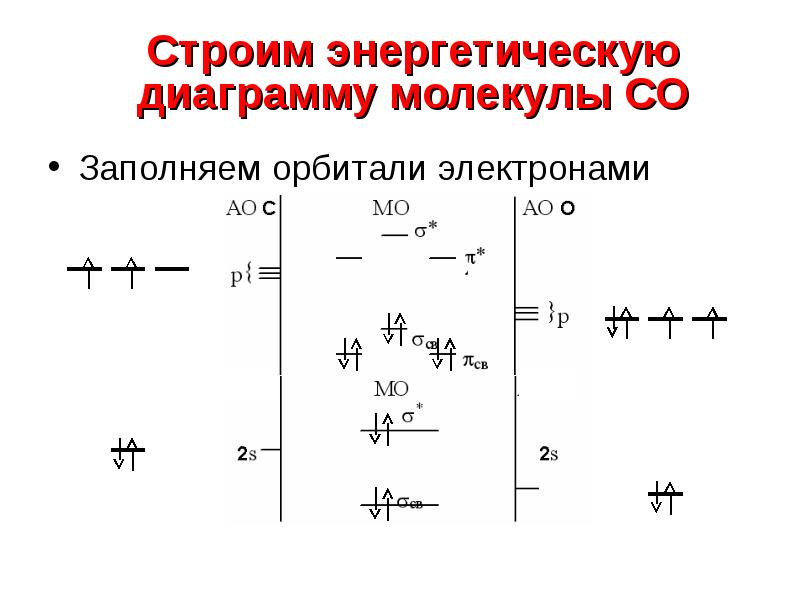
- 16. Cтроим энергетическую диаграмму молекулы СО 1. Строим АО внешнего уровня 2.
- 17. 3. Определяем тип перекрывания АО 3. Определяем тип перекрывания АО 2s
- 18. Заполняем орбитали электронами Заполняем орбитали электронами
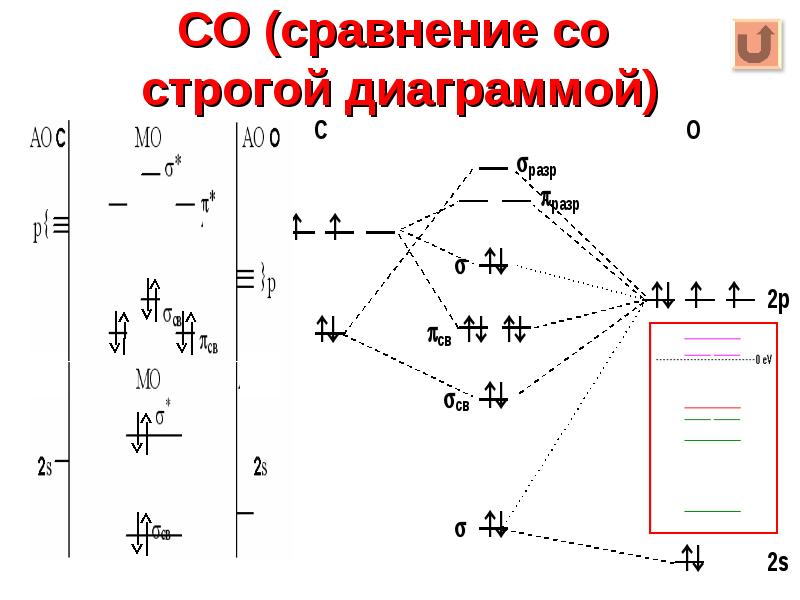
- 19. CO (сравнение со строгой диаграммой)
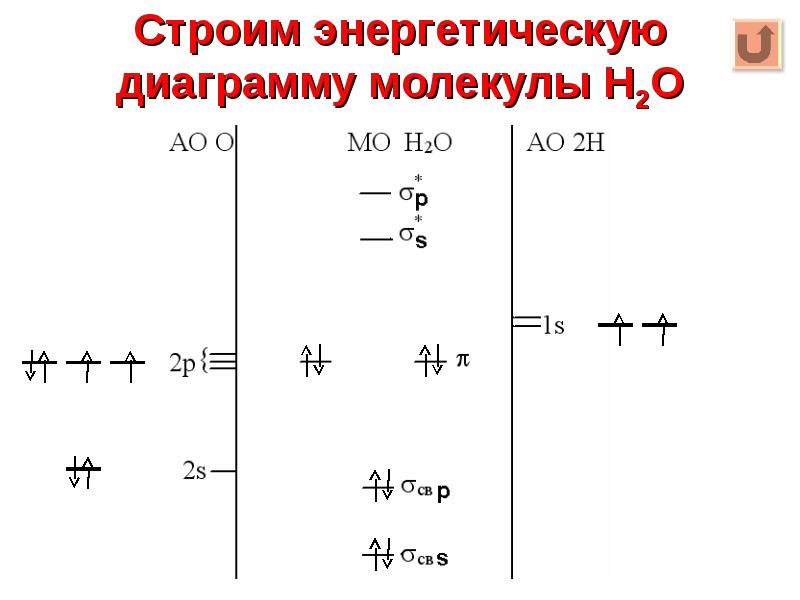
- 20. Строим энергетическую диаграмму молекулы Н2О 1. Строим АО внешнего уровня 2.
- 21. Строим энергетическую диаграмму молекулы Н2О 3. Определяем тип перекрывания АО 2s
- 22. Строим энергетическую диаграмму молекулы Н2О
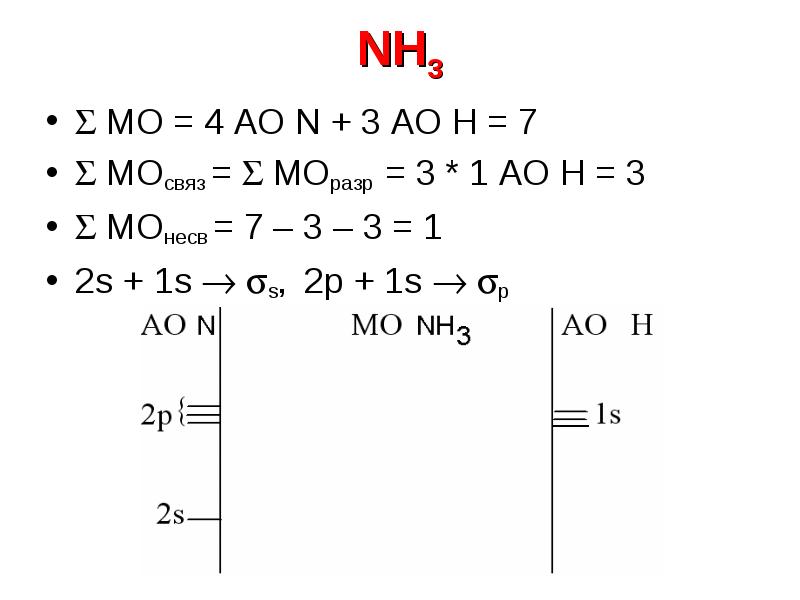
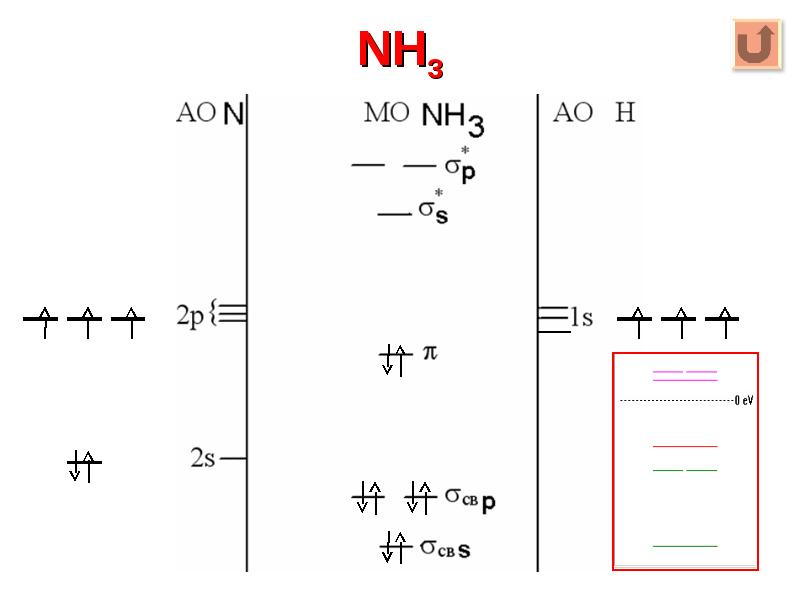
- 23. NH3 МО = 4 АО N + 3 АО Н
- 24. NH3
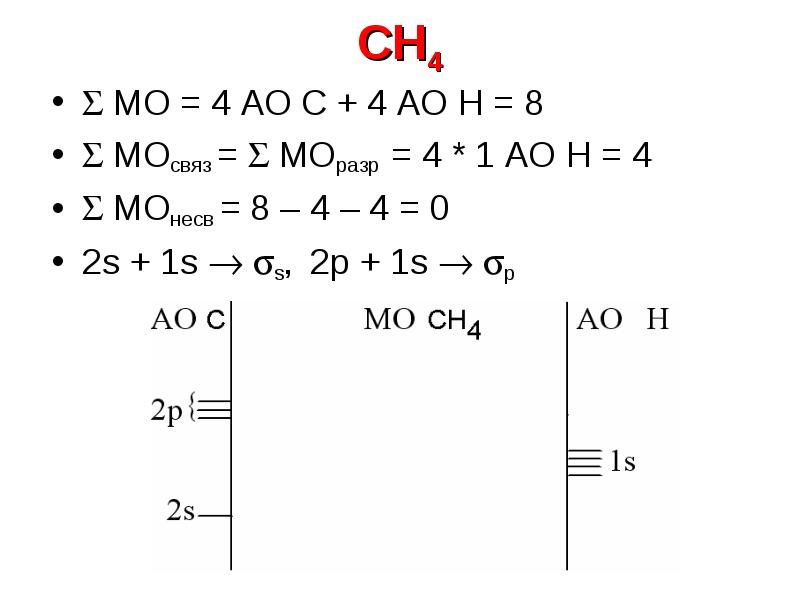
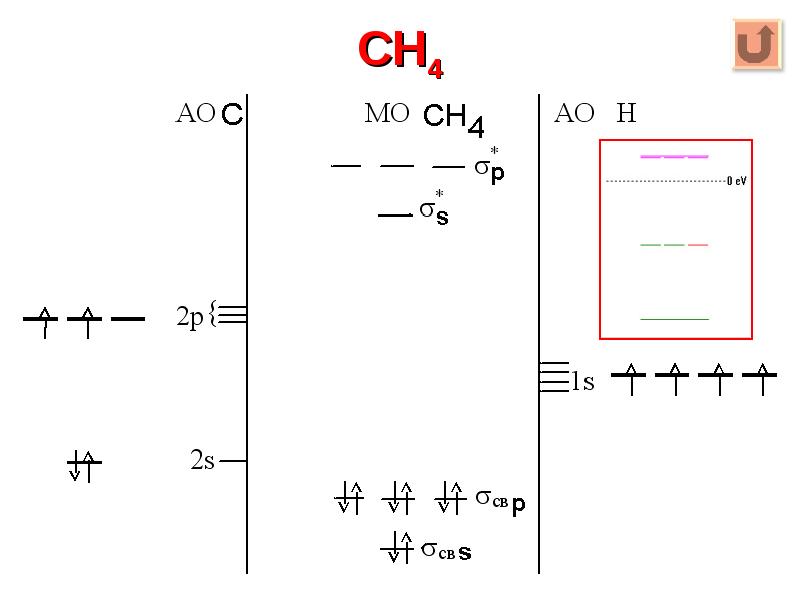
- 25. CH4 МО = 4 АО C + 4 АО Н
- 26. CH4
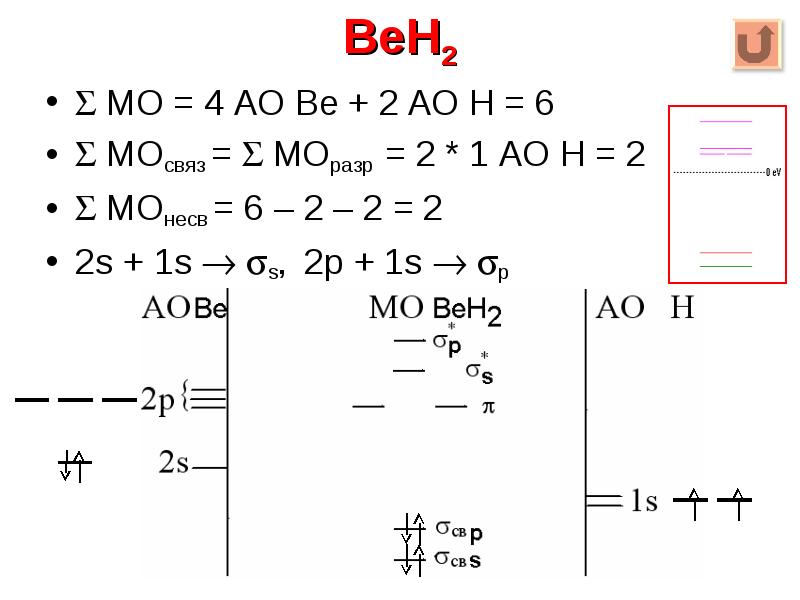
- 27. BeH2 МО = 4 АО Be + 2 АО Н
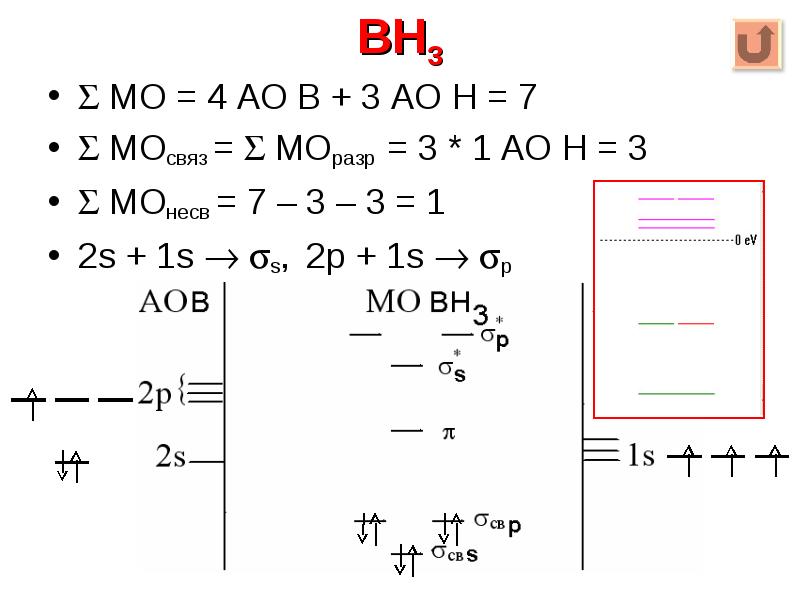
- 28. BH3 МО = 4 АО B + 3 АО Н
- 29. Скачать презентацию










Слайды и текст этой презентации
Похожие презентации





























