Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн презентация
Содержание
- 2. Метод нейтрализации Метод нейтрализации – это один из видов титриметрического анализа,
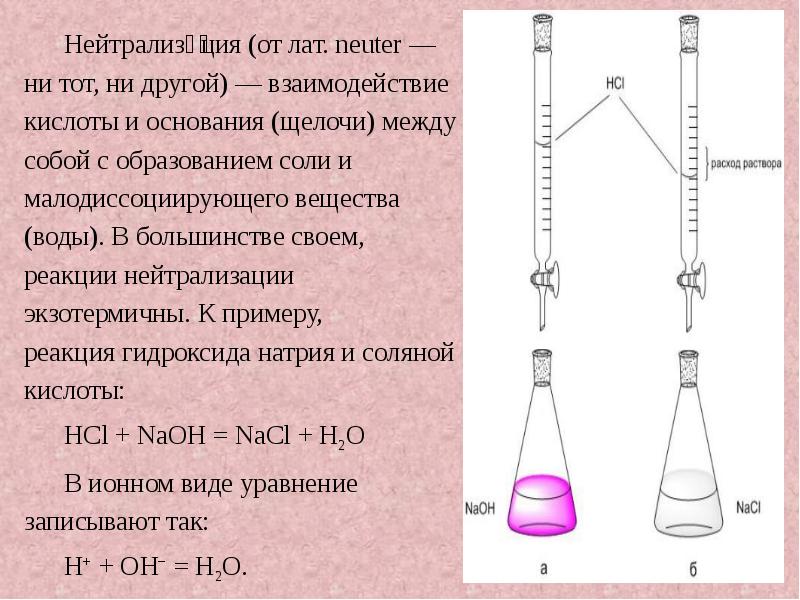
- 3. Нейтрализа́ция (от лат. neuter — ни тот, ни другой) — взаимодействие кислоты и основания (щелочи)
- 4. Кислотно-основное титрование Это метод, основанный на измерении объема рабочего раствора, пошедшего
- 5. Приемы титрования: 1) прямое титрование, когда анализируемое вещество титруется непосредственно рабочим
- 6. Расчеты в методе нейтрализации Требуется рассчитать массу щелочи .(mNaOH) в растворе
- 7. Ионное произведение воды Вода – слабый электролит. Запишем уравнение диссоциации
- 8. Так как К очень мала, то можно считать равновесную концентрацию воды
- 9. Водородный показатель pH Водородный показатель (pH) – это отрицательный десятичный логарифм
- 10. Ошибки метода нейтрализации Индикаторные ошибки относятся к систематическим ошибкам и возникают
- 11. Особенности, достоинства и недостатки метода Достоинствами PH являются ее универсальность и
- 12. Примеры: Примеры: 1. Рассчитать pH децинормального раствора HCl. Решение: НСl
- 13. Значение метода нейтрализации Данный метод позволяет анализировать кислоты, гидроксиды, соли, оксиды,
- 14. Список используемой литературы Отто М. Современные методы аналитической химии: в 2
- 15. Скачать презентацию













Слайды и текст этой презентации
Скачать презентацию на тему Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн можно ниже:
Похожие презентации





























