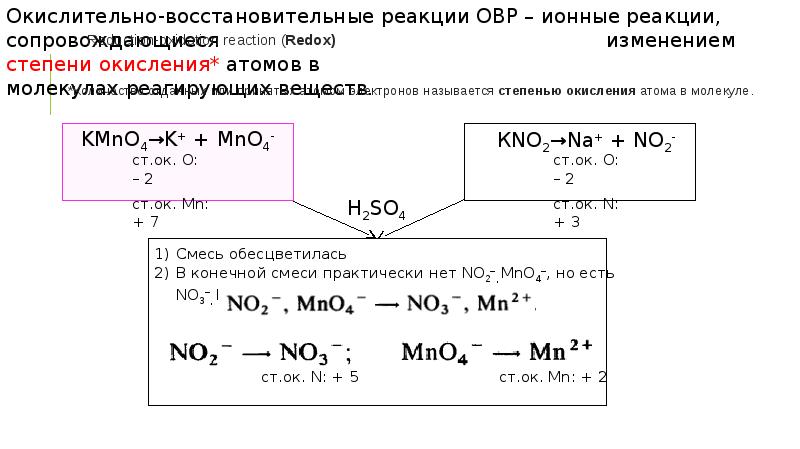
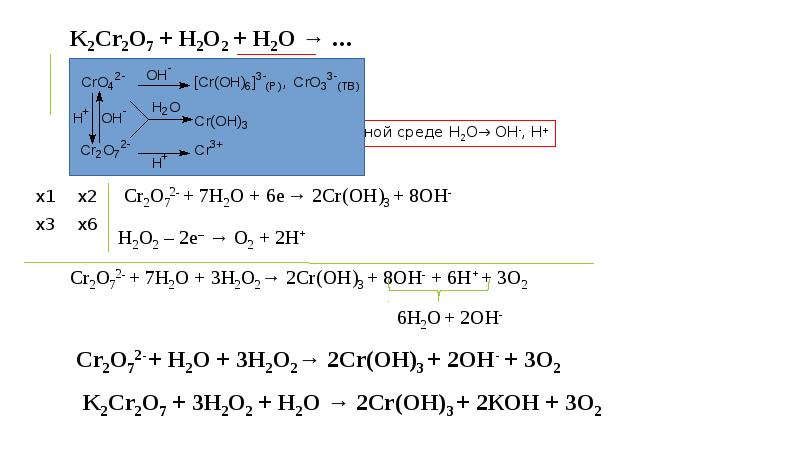
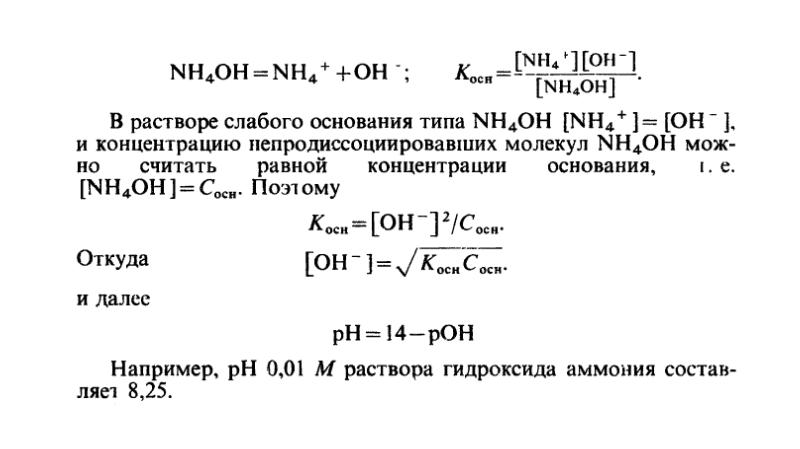
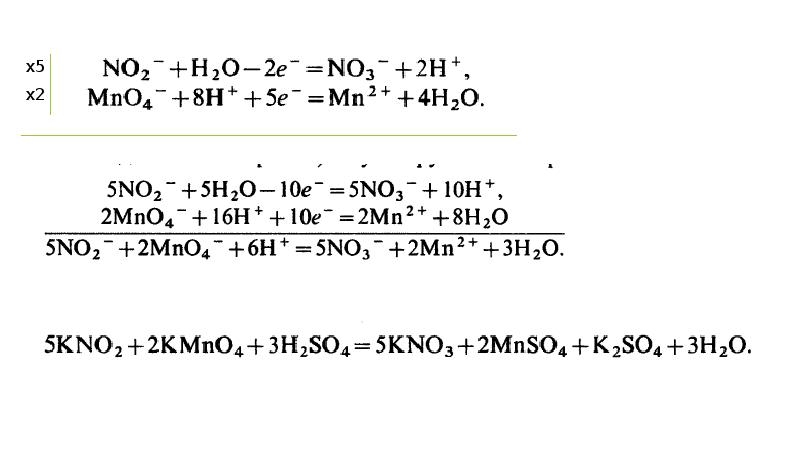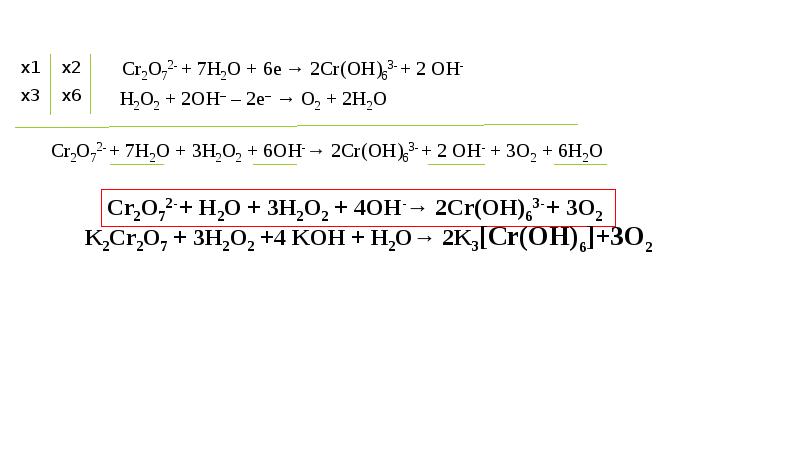Окислительно-восстановительные процессы. Рн, нейтрализация презентация
Слайды и текст этой презентации
Скачать презентацию на тему Окислительно-восстановительные процессы. Рн, нейтрализация можно ниже:
Похожие презентации