Окислительно-восстановительные реакции презентация
Содержание
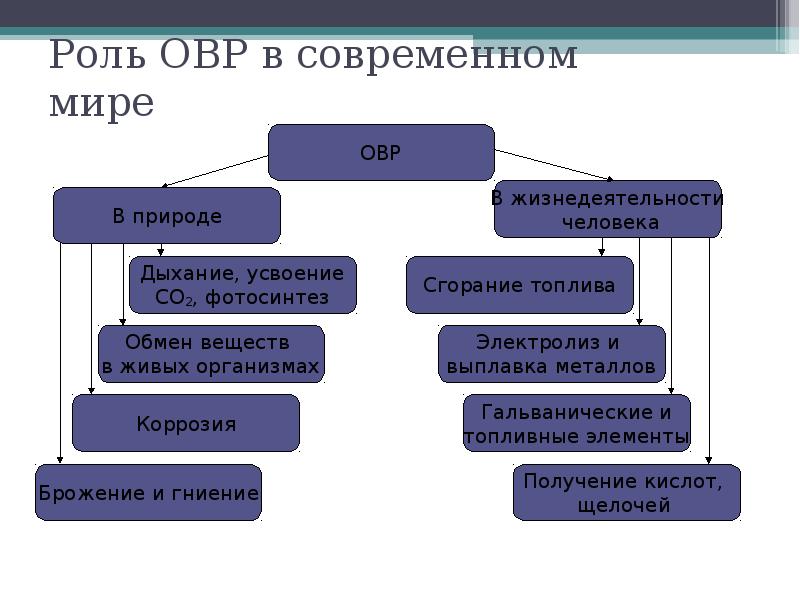
- 2. Роль ОВР в современном мире
- 3. Расчет степени окисления Следует запомнить: 1. Степени окисления атомов в простых
- 4. Окислительно-восстановительные реакции Реакции, протекающие с изменением степени окисления, называются окислительно-восстановительными
- 5. Степень окисления (СО)
- 6. Окислитель -Частица (атом, ион), которая в ходе окислительно-восстановительного процесса принимает электроны
- 7. Восстановитель Частица (атом, ион), которая в ходе окислительно-восстановительного процесса отдает электроны,
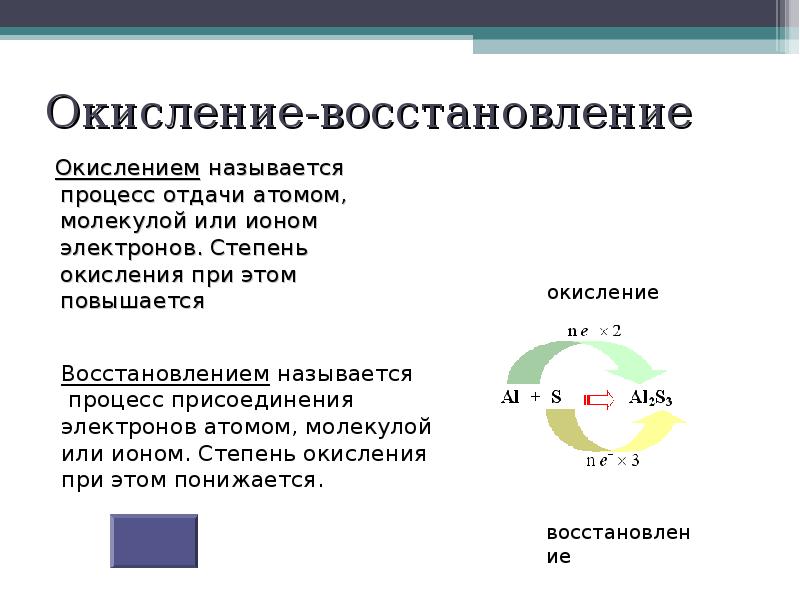
- 8. Окисление-восстановление
- 9. Окисление-процесс отдачи электронов 0
- 10. +2 0
- 11. Алгоритм расстановки коэффициентов в ОВР методом электронного баланса Запишите схему реакции:
- 12. Расставьте коэффициенты методом электронного баланса 1). NH3 + O2 → NO +
- 13. Скачать презентацию










Слайды и текст этой презентации
Скачать презентацию на тему Окислительно-восстановительные реакции можно ниже:
Похожие презентации





























