Окислительно-восстановительные реакции (лекция 6) презентация
Содержание
- 4. Примеры: Примеры: V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
- 5. Существует два типа химических реакций: Существует два типа химических реакций:
- 6. B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих
- 7. В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят
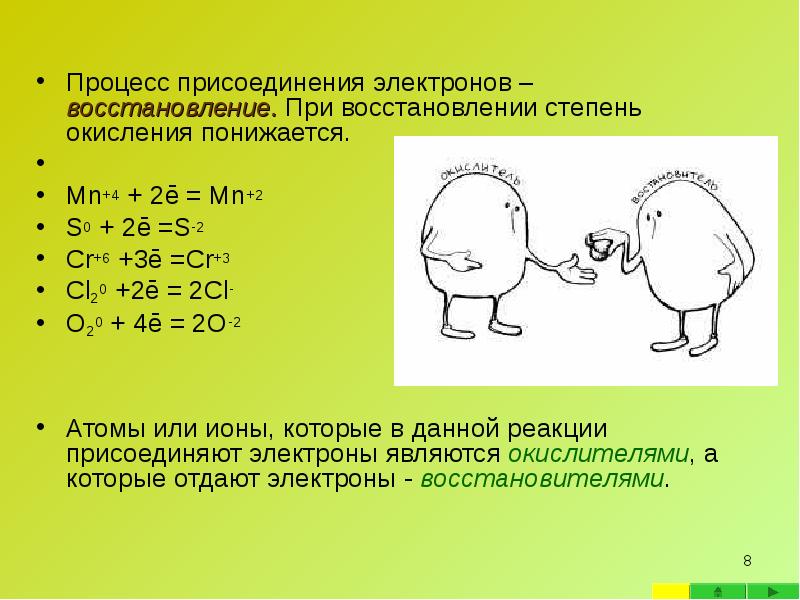
- 8. Процесс присоединения электронов – восстановление. При восстановлении степень окисления понижается. Процесс
- 9. Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только
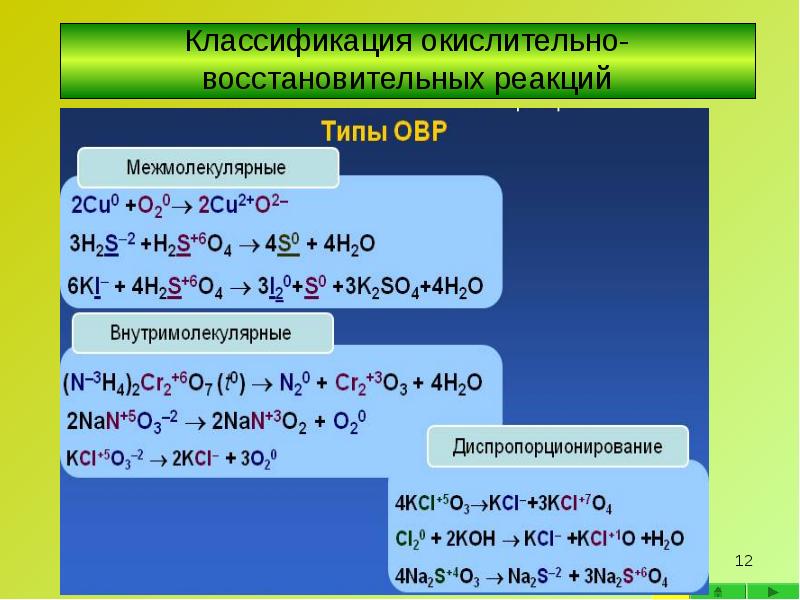
- 13. Межмолекулярные окислительно-восстановительные реакции Межмолекулярные окислительно-восстановительные реакции Окислитель и восстановитель находятся в
- 14. Внутримолекулярные окислительно- восстановительные реакции Внутримолекулярные окислительно- восстановительные реакции
- 15. Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и
- 16. Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций,
- 20. B Электронно-ионный баланс (метод полуреакций) - метод нахождения коэффициентов, в котором
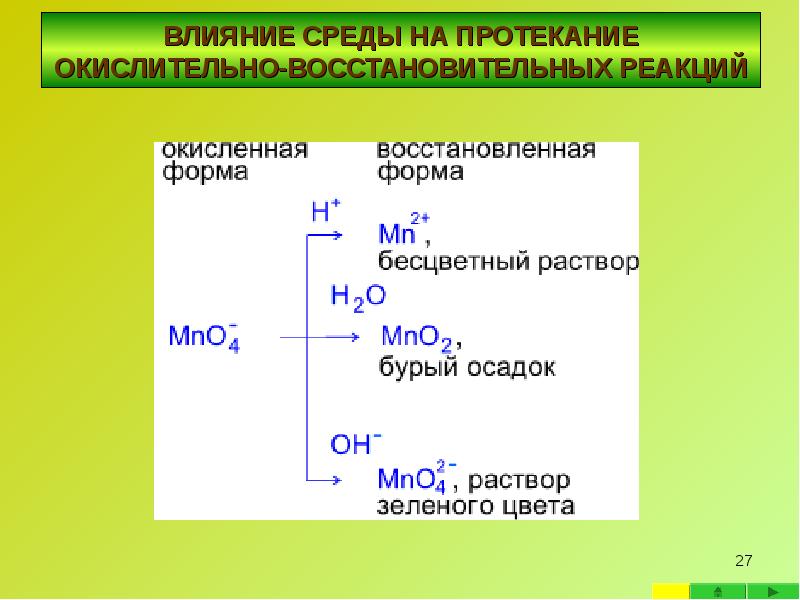
- 23. ВЛИЯНИЕ СРЕДЫ НА ПРОТЕКАНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ
- 24. Реакции с участием перманганата калия в качестве окислителя Реакции с
- 25. Реакции в нейтральной среде Реакции в нейтральной среде
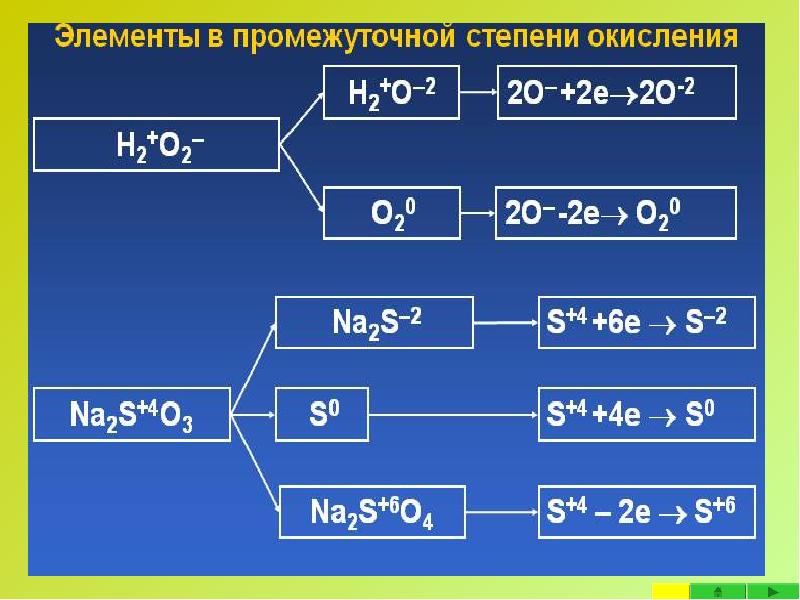
- 28. При взаимодействии веществ, содержащих в своем составе элементы в промежуточных степенях
- 29. Алгоритм действия: Алгоритм действия: По таблице потенциалов определяют потенциалы окислителя
- 30. Возможен ли процесс: Cu + FeCl3 →? + ? Выписывают из
- 32. Скачать презентацию



























Слайды и текст этой презентации
Скачать презентацию на тему Окислительно-восстановительные реакции (лекция 6) можно ниже:
Похожие презентации





























