Олово и свинец. (Лекция 2) презентация
Содержание
- 2. Sn, Pb
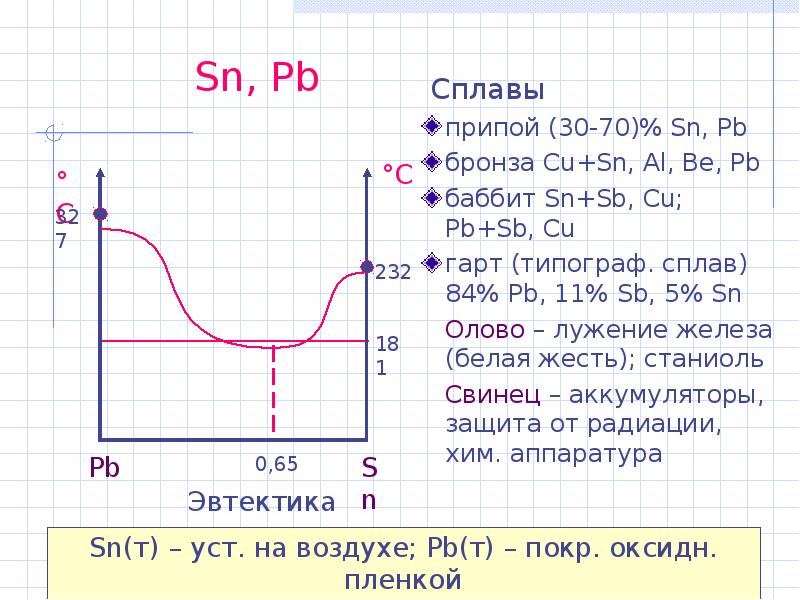
- 3. Sn, Pb Cплавы припой (30-70)% Sn, Pb бронза Cu+Sn, Al, Be,
- 4. В ЭХРН: Zn… Al… Sn… Pb H Cu…Ag Hg Получение металлов
- 5. ЭII Оксиды ЭО
- 6. Аквакатионы ЭII [Э(H2O)3]2+ + H2O [Э(H2O)2(OH)]+ + H3O+ SnII –
- 7. Соли SnII Соли PbII [Pb2+]: PbSO4 > PbCrO4 > PbS
- 8. ЭIV Оксиды ЭО2 амфотерн. с преобладанием кислотн. св-в полигидраты ЭO2.n H2O (уст.
- 9. Окислительно-восстановительные свойства Sn2+ – мягкий восстановитель рН < 7 (HCl): [SnCl3]–
- 10. Окислительно-восстановительные свойства PbO2 – сильный окислитель рН < 7: PbO2 +
- 11. Разделение олова и свинца (сульфидный метод)
- 12. Скачать презентацию




![Аквакатионы ЭII [Э(H2O)3]2+ + H2O [Э(H2O)2(OH)]+ + H3O+
SnII Аквакатионы ЭII [Э(H2O)3]2+ + H2O [Э(H2O)2(OH)]+ + H3O+
SnII](/documents_3/140b06d1226be6be909d6258c453cba8/img5.jpg)
![Соли SnII Соли PbII
[Pb2+]: PbSO4 > PbCrO4 > Соли SnII Соли PbII
[Pb2+]: PbSO4 > PbCrO4 >](/documents_3/140b06d1226be6be909d6258c453cba8/img6.jpg)

![Окислительно-восстановительные свойства
Sn2+ – мягкий восстановитель
рН < 7 (HCl): [SnCl3]– Окислительно-восстановительные свойства
Sn2+ – мягкий восстановитель
рН < 7 (HCl): [SnCl3]–](/documents_3/140b06d1226be6be909d6258c453cba8/img8.jpg)


Слайды и текст этой презентации
Похожие презентации





























