Органическая химия. Лекция - Гидроксикислоты презентация
Содержание
- 2. Цели лекции: Обучающая - Сформировать знания о строении, номенклатуре и реакционной
- 3. Классификация. Номенклатура. Гидроксикислоты – производные карбоновых кислот, у которых один или
- 4. Классификация. Номенклатура. Номенклатура. По заместительной номенклатуре ИЮПАК название производят от названия
- 5. Отдельные представители Отдельные представители: 1. Молочная кислота (2-гидроксипропановая кислота, α-гидроксипропионовая
- 6. Отдельные представители 2. β-гидроксимасляная кислота (3-гидроксибутановая кислота) Алифатическая, одноосновная,
- 7. Отдельные представители 3. Яблочная кислота (2-гидроксибутандиовая кислота, α-гидроксиянтарная кислота) Алифатическая, двухосновная,
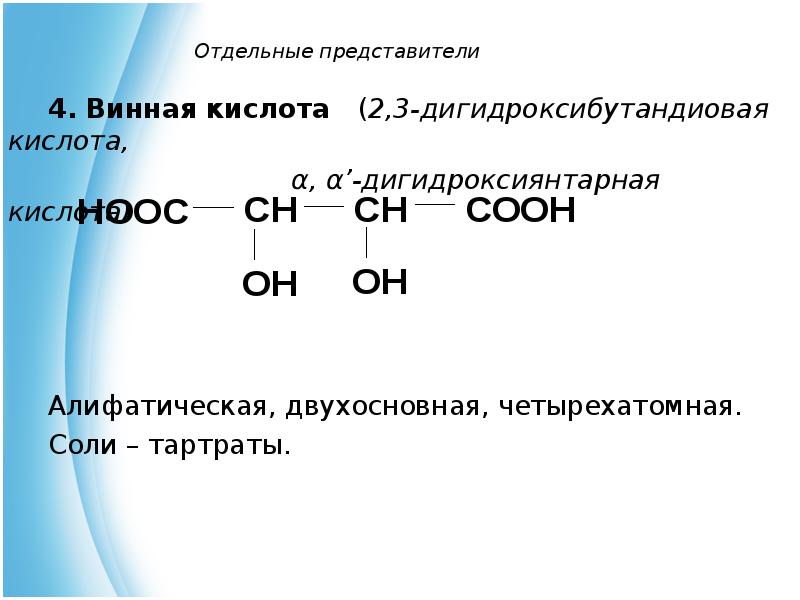
- 8. Отдельные представители 4. Винная кислота (2,3-дигидроксибутандиовая кислота, α,
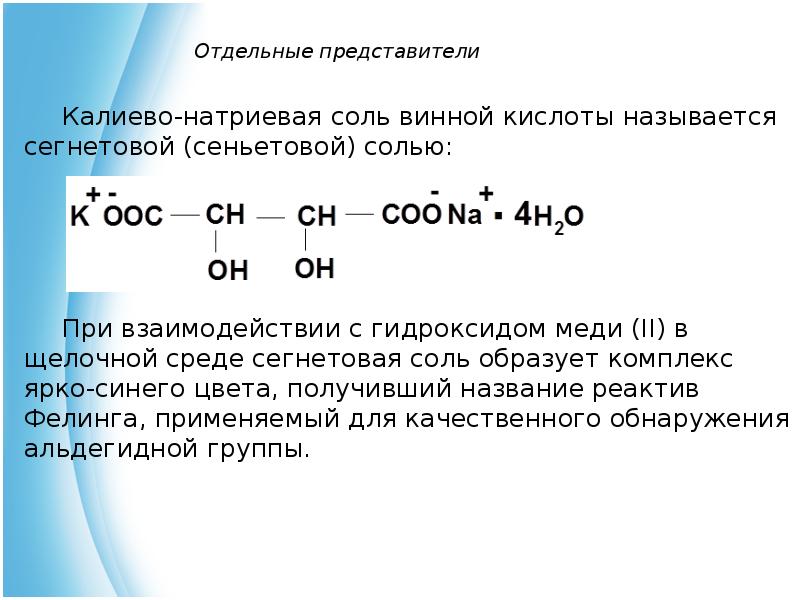
- 9. Отдельные представители Калиево-натриевая соль винной кислоты называется сегнетовой (сеньетовой) солью: При
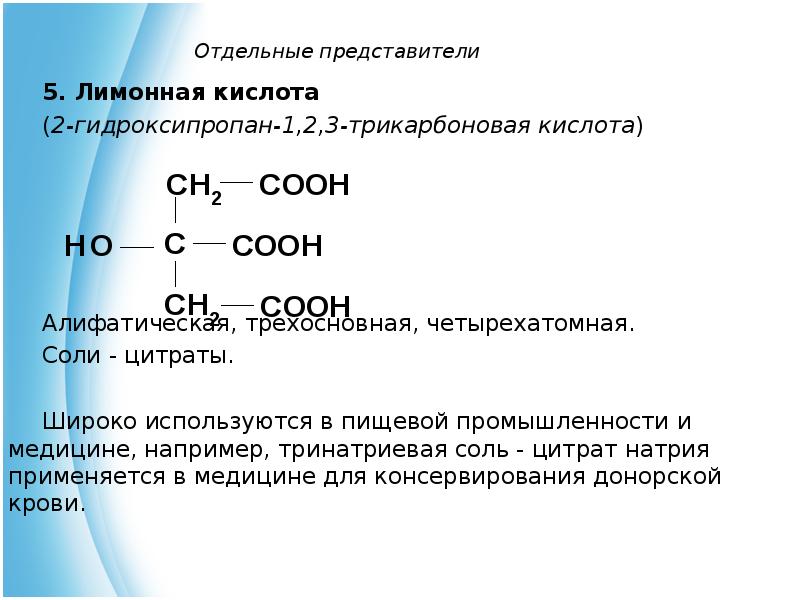
- 10. Отдельные представители 5. Лимонная кислота (2-гидроксипропан-1,2,3-трикарбоновая кислота)
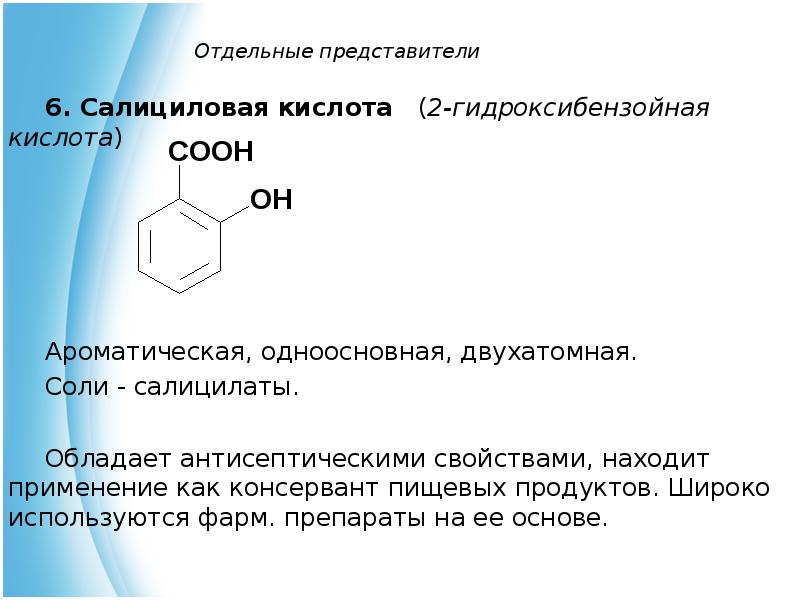
- 11. Отдельные представители 6. Салициловая кислота (2-гидроксибензойная кислота)
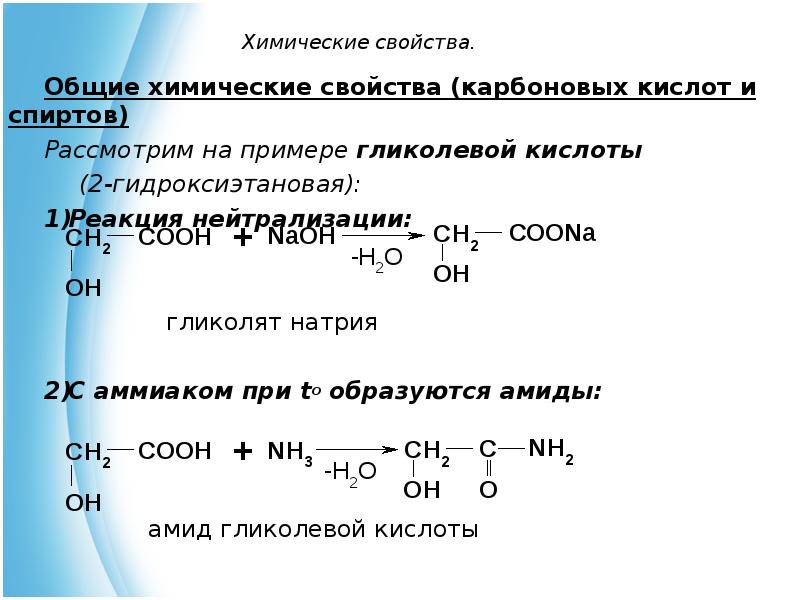
- 12. Химические свойства. Общие химические свойства (карбоновых кислот и спиртов) Рассмотрим на
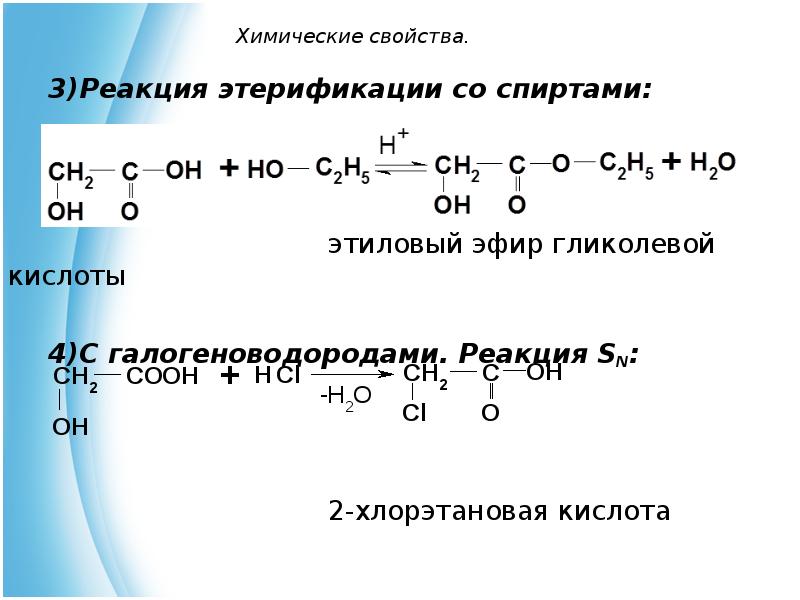
- 13. Химические свойства. Реакция этерификации со спиртами: этиловый эфир
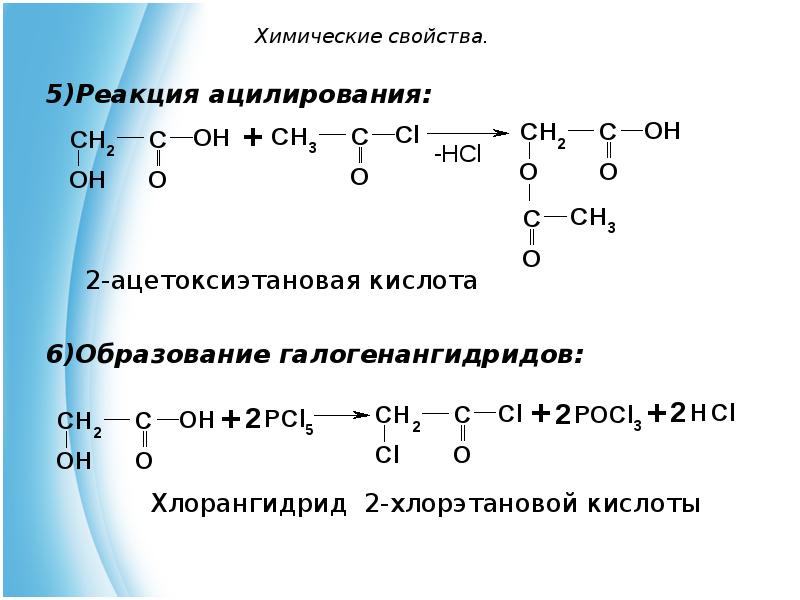
- 14. Химические свойства. Реакция ацилирования: 2-ацетоксиэтановая кислота Образование галогенангидридов:
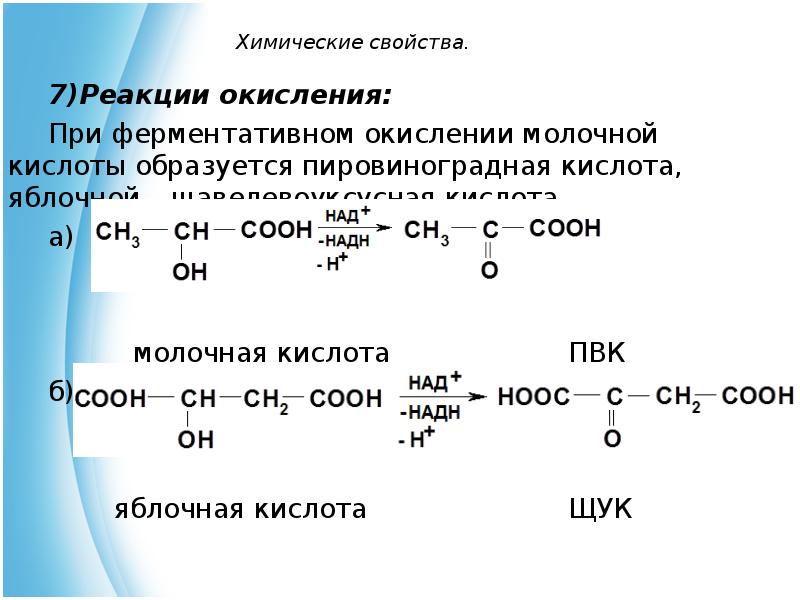
- 15. Химические свойства. Реакции окисления: При ферментативном окислении молочной кислоты образуется пировиноградная
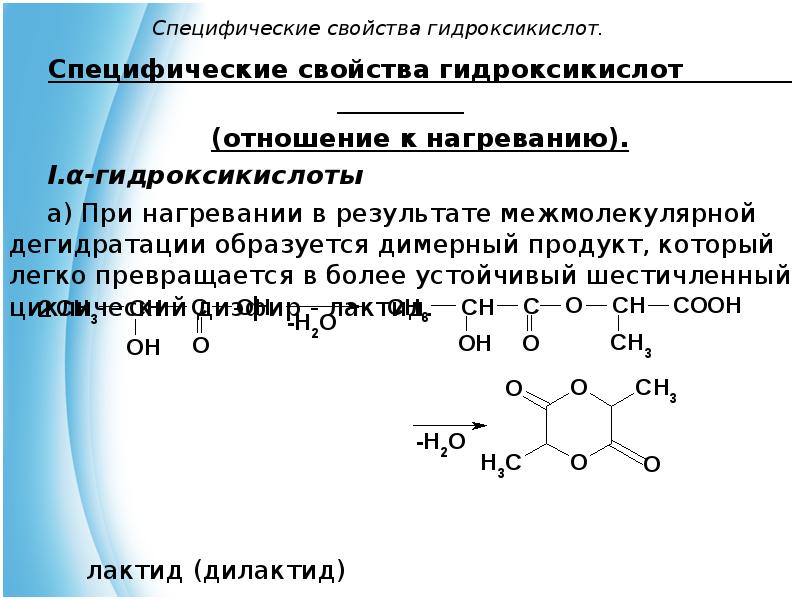
- 16. Специфические свойства гидроксикислот. Специфические свойства гидроксикислот
- 17. Специфические свойства гидроксикислот. Лактидами называются циклические эфиры, построенные из двух и
- 18. Специфические свойства гидроксикислот. При кипячении с разбавленными минеральными кислотами отщепляют муравьиную
- 19. Специфические свойства гидроксикислот. β-гидроксикислоты При нагревании или под действием минеральных кислот
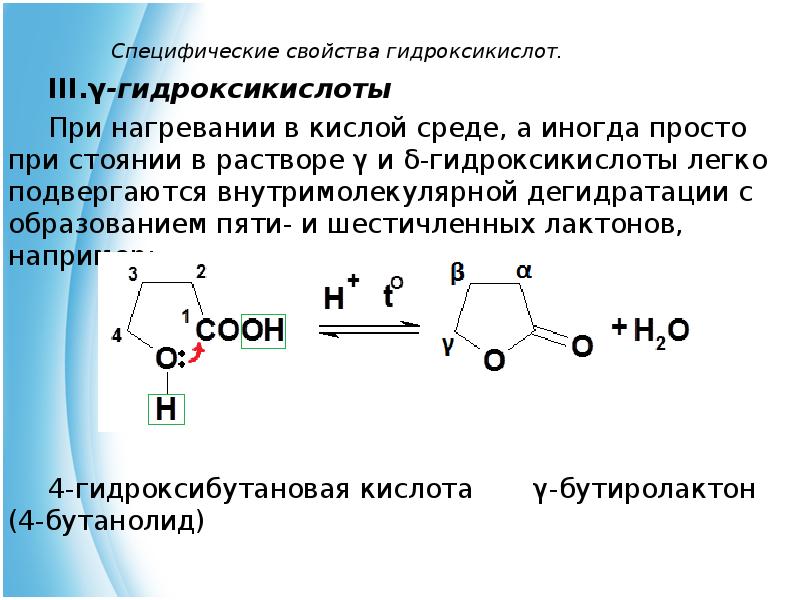
- 20. Специфические свойства гидроксикислот. γ-гидроксикислоты При нагревании в кислой среде, а иногда
- 21. Специфические свойства гидроксикислот. Лактонами называются внутренние сложные эфиры гидроксикислот. По
- 22. Ароматические гидроксикислоты. Ароматические гидроксикислоты (фенолокислоты) Это производные ароматических карбоновых кислот, у
- 23. Ароматические гидроксикислоты. Орто-гидроксикоричная кислота: Существует в виде 2-х геометрических
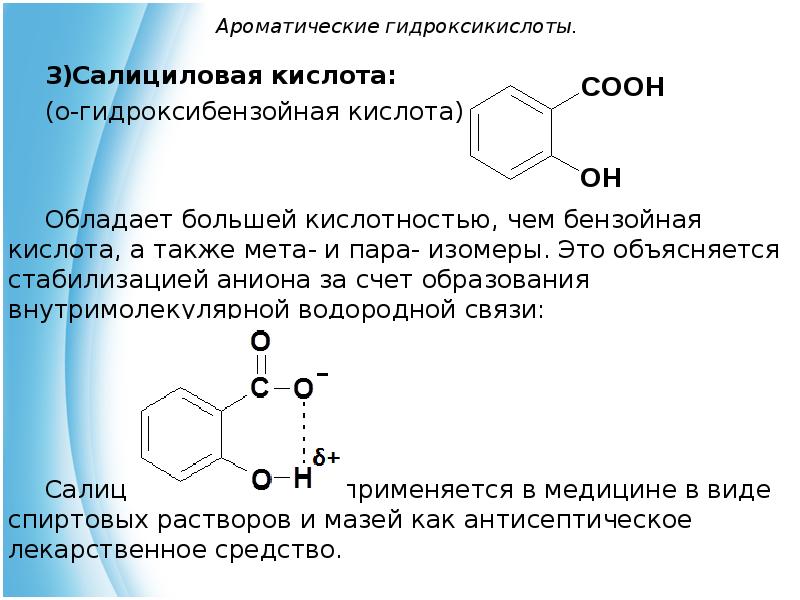
- 24. Ароматические гидроксикислоты. Салициловая кислота: (о-гидроксибензойная кислота) Обладает большей кислотностью,
- 25. Ароматические гидроксикислоты. Фармпрепараты на основе салициловой кислоты. Метилсалицилат: Используется как противовоспалительное,
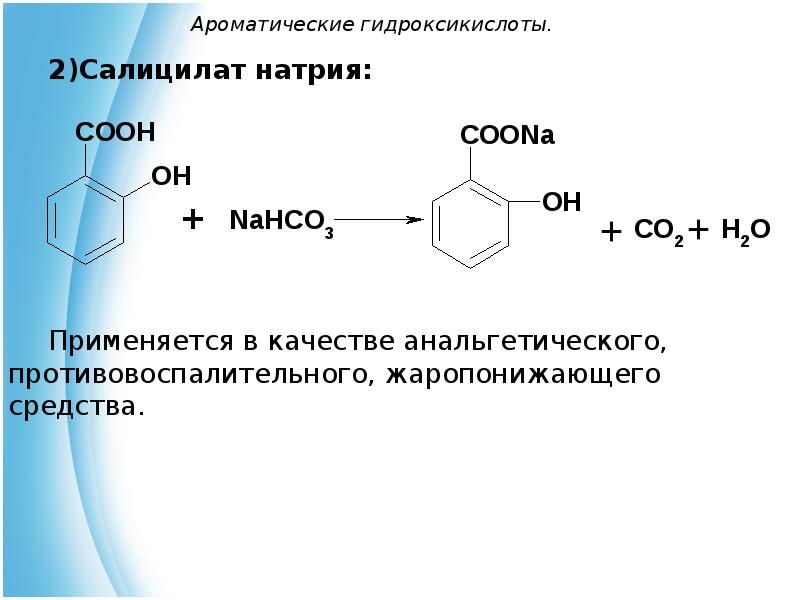
- 26. Ароматические гидроксикислоты. Салицилат натрия: Применяется в качестве анальгетического, противовоспалительного, жаропонижающего
- 27. Ароматические гидроксикислоты. Фенилсалицилат (салол): салицилат хлорангидрид
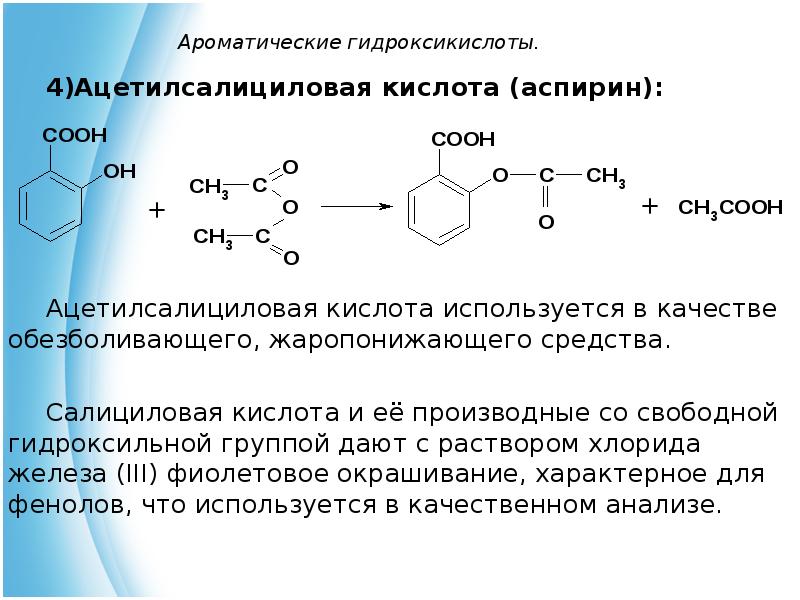
- 28. Ароматические гидроксикислоты. Ацетилсалициловая кислота (аспирин): Ацетилсалициловая кислота используется в качестве
- 30. Скачать презентацию
















Слайды и текст этой презентации
Скачать презентацию на тему Органическая химия. Лекция - Гидроксикислоты можно ниже:
Похожие презентации





























