Понятие о коррозии металлов. Способы защиты от коррозии презентация
Содержание
- 2. Девиз: «Знать – значит победить» Цель работы Задачи
- 6. «Знать – значит победить» А. Н. Несмеянов Цели урока: познакомиться с
- 7. Графический диктант
- 8. Графический диктант Металлом можно воспользоваться для получения серебра из его соли.
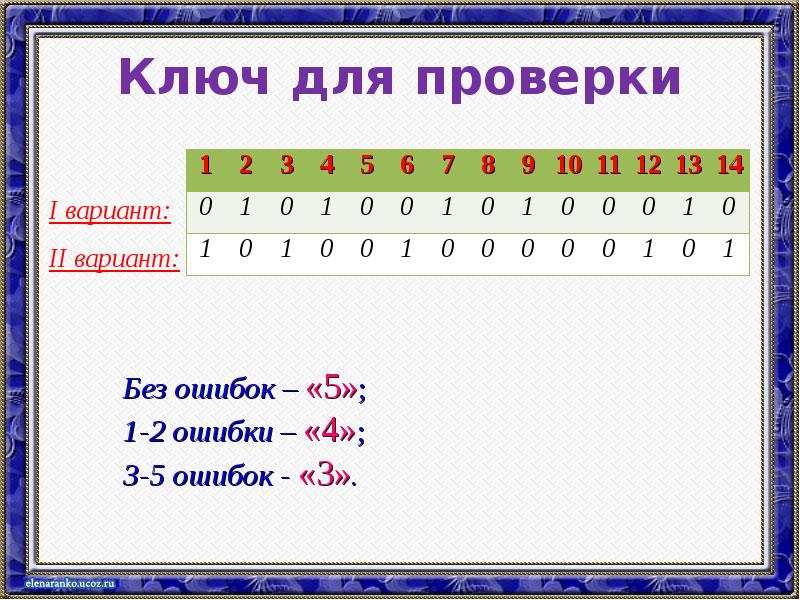
- 9. Ключ для проверки I вариант: II вариант:
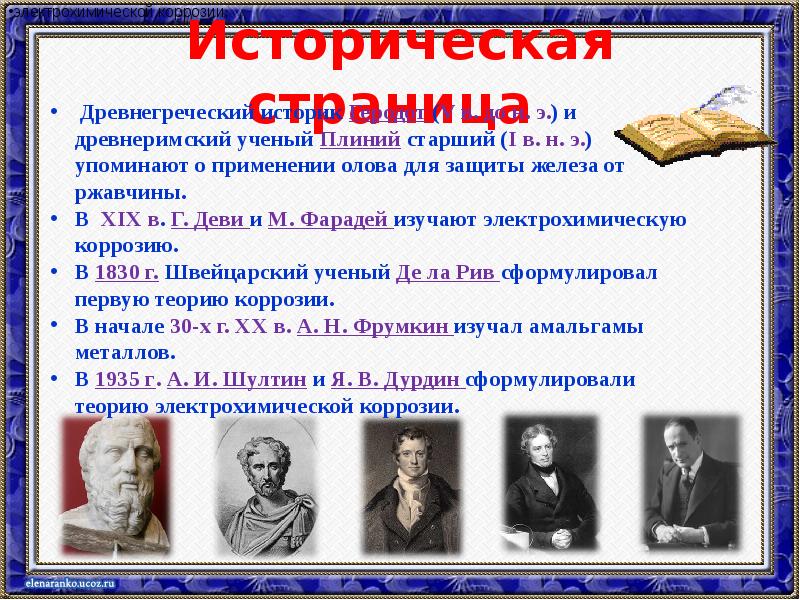
- 10. Историческая страница
- 11. Информационная страница КОРРОЗИЯ – это разрушение металлов и сплавов под действием
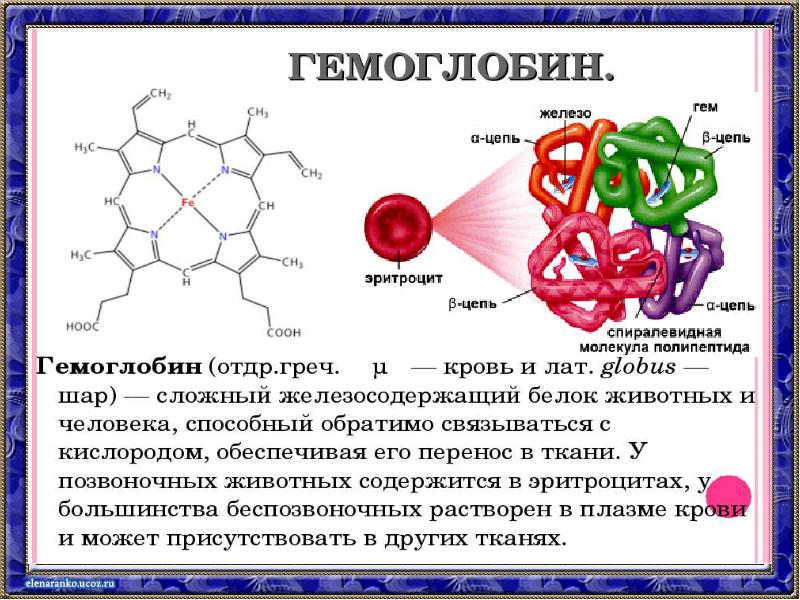
- 13. Почему темнеет яблоко?
- 14. Интересные факты
- 15. Интересные факты
- 16. Информационная страница КОРРОЗИЯ – это окислительно-восстановительный процесс, при котором атомы металла
- 18. Химическая коррозия
- 19. Электрохимическая коррозия
- 23. По характеру разрушений
- 24. Сплошная коррозия
- 25. Местная коррозия
- 26. Причины возникновения местной коррозии
- 27. Факторы, влияющие на скорость коррозии
- 28. Цель: исследовать влияние сред, контактов металлов на скорость коррозии
- 30. Метод исследования
- 31. Что делали 1 стакан: Fe + H2O 2 стакан: Fe +
- 32. Результат эксперимента
- 33. Что наблюдали Стакан №1. Железо слабо прокорродировало, в чистой воде
- 34. Стакан №2. Стакан №2. Скорость коррозии выше, чем в первом
- 38. Вывод Действительно, мы увидели, что скорость коррозии меняется в зависимости
- 40. Консервная банка
- 41. Оцинкованное ведро
- 43. Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических
- 44. Практическая страница Способы защиты металлов от коррозии: Шлифование поверхностей.
- 45. Практическая страница Способы защиты металлов от коррозии: Использование легированных
- 46. Практическая страница Способы защиты металлов от коррозии: Нанесение защитных
- 47. Практическая страница Способы защиты металлов от коррозии: Нанесение защитных
- 48. Практическая страница Способы защиты металлов от коррозии: Нанесение защитных
- 49. Практическая страница Способы защиты металлов от коррозии: Электрохимические методы
- 50. Практическая страница Способы защиты металлов от коррозии: Электрохимические методы:
- 51. Практическая страница Способы защиты металлов от коррозии: Обработка среды
- 52. Нанотехнология. Самовосстанавливающийся газопровод.
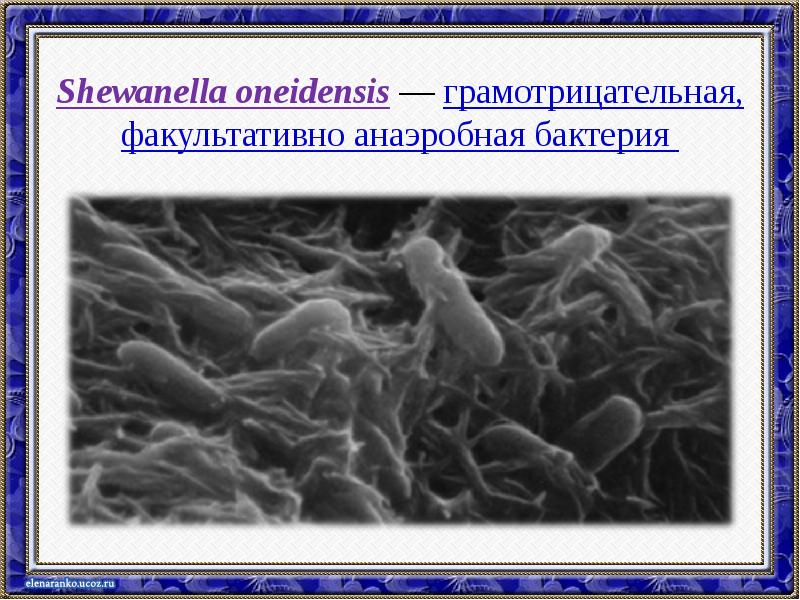
- 53. Shewanella oneidensis — грамотрицательная, факультативно анаэробная бактерия
- 54. «Стоп! Красный свет!» Вопросы: Что такое коррозия? Какие виды коррозии вы
- 55. Задача
- 56. Задача
- 57. Задача
- 58. Задача
- 59. Задача
- 61. Рефлексия
- 62. Домашнее задание 24 стр. 108-118. вопросы 1, 4, 5 на стр.
- 63. Скачать презентацию

























































Слайды и текст этой презентации
Скачать презентацию на тему Понятие о коррозии металлов. Способы защиты от коррозии можно ниже:
Похожие презентации





























