Предмет, задачи и значение физической химии презентация
Содержание
- 2. ФИЗИЧЕСКАЯ ХИМИЯ Наука о закономерностях химических процессов и химических явлений. Объясняет
- 3. ФИЗИЧЕСКАЯ ХИМИЯ Задачи: - изучение строения и свойств вещества и составляющих
- 4. Основные разделы Строение вещества Химическая термодинамика Химическая кинетика и равновесие Учение
- 5. ФИЗИЧЕСКАЯ ХИМИЯ Все разделы физической химии объединяет единая основа – общие
- 6. ФИЗИЧЕСКАЯ ХИМИЯ Основоположник - М. В. Ломоносов (1711-1765)
- 7. ФИЗИЧЕСКАЯ ХИМИЯ Внесли огромный вклад в развитие науки – Карно,
- 8. ФИЗИЧЕСКАЯ ХИМИЯ Многие специальные дисциплины (агрохимия, физиология растений и животных, биохимия,
- 9. ФИЗИЧЕСКАЯ ХИМИЯ Особое значение физической химии состоит в формировании у студентов
- 10. Строение вещества Молекулярно-кинетическая теория объясняет свойства тел взаимодействием и движением молекул
- 11. Агрегатные состояния Газообразное состояние идеальный газ - в котором можно пренебречь
- 12. Агрегатные состояния Плазменное состояние частично или полностью ионизированный газ, в котором
- 13. Агрегатные состояния Жидкое состояние вещества Поверхностное натяжение - сила, которая
- 14. Агрегатные состояния Твердое состояние вещества Типы кристаллических решеток триклинная моноклинная ромбическая
- 15. Лекция № 2 Тема: Основы химической термодинамики
- 16. Химическая термодинамика Нулевым (или общим) началом термодинамики называют принцип, согласно которому
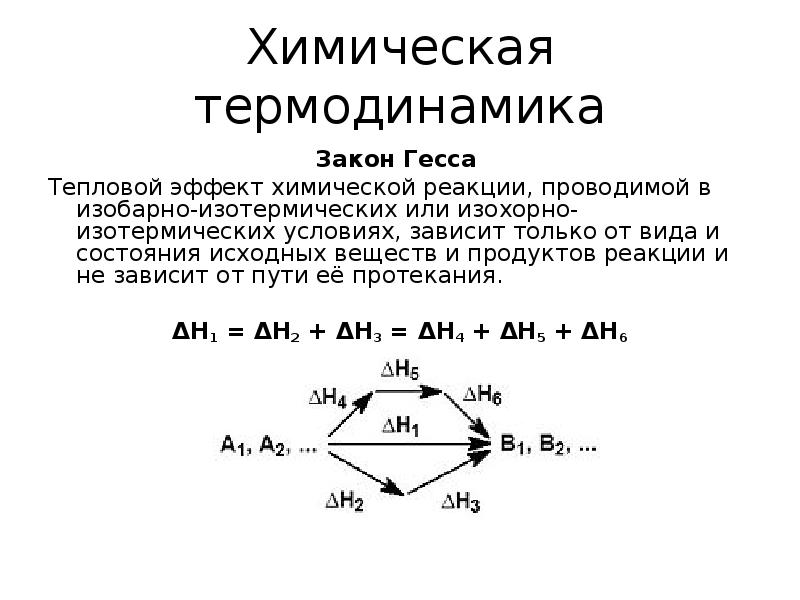
- 17. Химическая термодинамика Закон Гесса Тепловой эффект химической реакции, проводимой в
- 18. Химическая термодинамика Следствия из закона Гесса Тепловой эффект прямой реакции равен
- 19. Химическая термодинамика В химических процессах одновременно действуют два противоположных фактора —
- 20. Скачать презентацию


















Слайды и текст этой презентации
Скачать презентацию на тему Предмет, задачи и значение физической химии можно ниже:
Похожие презентации





























