Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии презентация
Содержание
- 2. План 1. Комплексные соединения их структура и классификация. 2. Константа образования
- 5. Классификация По характеру связи между составными частями комплекса: а) внутрисферные имеют
- 6. Классификация Классификация По числу центральных атомов: а) моноядерные; б) полиядерные.
- 7. Константа образования M(S)n + L M(S)(n-1)L + S
- 8. Константа образования или устойчивости β: M + L ↔ [ML]
- 9. Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+
- 10. [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- [Ag(NH3)2]+ [AgNH3]+ + NH3 [AgNH3]+
- 11. Константа нестойкости Кнест.
- 12. [Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+ [Ag(NH3)2]Cl + 2H+ →
- 13. [Ag(NH3)2]+ + I- → AgI↓+ 2NH3
- 14. Переведение комплексообразователя в другой, более прочный, комплексный ион Переведение комплексообразователя в
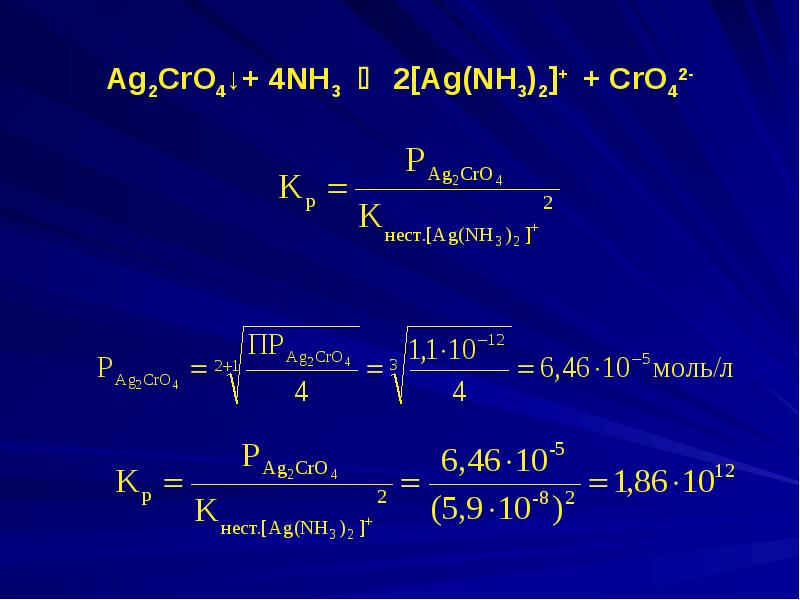
- 17. а) осуществляется ли реакция: AgСl + 2NH3 [Ag(NH3)2]+
- 18. б) Возможен ли перевод катионов VI группы из осадков гидроксидов в
- 20. Скачать презентацию







![Константа образования или устойчивости β:
M + L ↔ [ML] Константа образования или устойчивости β:
M + L ↔ [ML]](/documents_3/0db0afe163335758d60c9d435880d093/img7.jpg)
![Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+ Ag+ + NH3 [AgNH3]+ [AgNH3]+ + NH3 [Ag(NH3)2]+](/documents_3/0db0afe163335758d60c9d435880d093/img8.jpg)
![[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ [AgNH3]+ + NH3
[AgNH3]+ [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ [AgNH3]+ + NH3
[AgNH3]+](/documents_3/0db0afe163335758d60c9d435880d093/img9.jpg)

![[Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+
[Ag(NH3)2]Cl + 2H+ → [Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+
[Ag(NH3)2]Cl + 2H+ →](/documents_3/0db0afe163335758d60c9d435880d093/img11.jpg)
![[Ag(NH3)2]+ + I- → AgI↓+ 2NH3 [Ag(NH3)2]+ + I- → AgI↓+ 2NH3](/documents_3/0db0afe163335758d60c9d435880d093/img12.jpg)



![а) осуществляется ли реакция: AgСl + 2NH3 [Ag(NH3)2]+ а) осуществляется ли реакция: AgСl + 2NH3 [Ag(NH3)2]+](/documents_3/0db0afe163335758d60c9d435880d093/img16.jpg)

Слайды и текст этой презентации
Скачать презентацию на тему Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии можно ниже:
Похожие презентации





























