Протолитическая теория кислот и оснований презентация
Содержание
- 2. Теория Аррениуса Кислота: HCI H+ + CI- Основание: NaOH
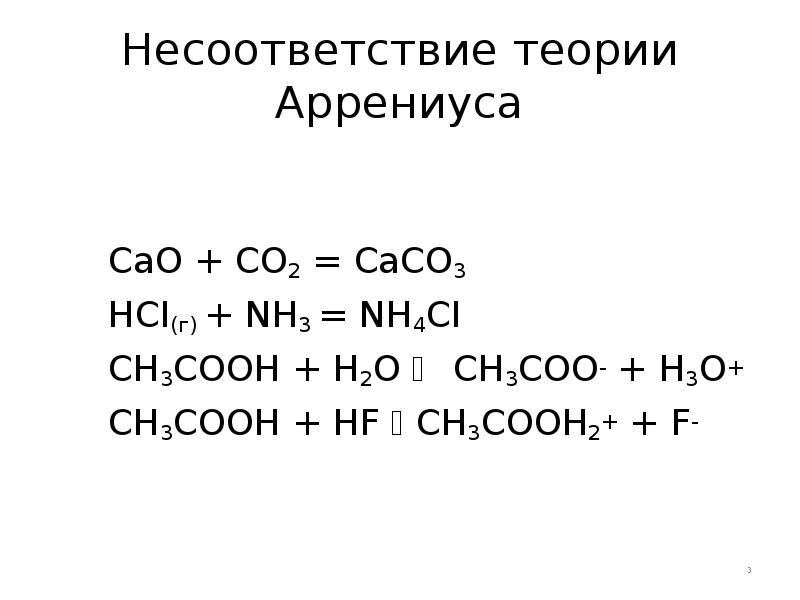
- 3. Несоответствие теории Аррениуса CaO + CO2 = CaCO3 HCI(г) + NH3
- 4. Протолитическая теория Определение кислоты и основания включает в себя молекулы и
- 5. Классификация кислот Нейтральные кислоты (HCI, HNO3, CH3COOH, H2SO4, H3PO4) HCI
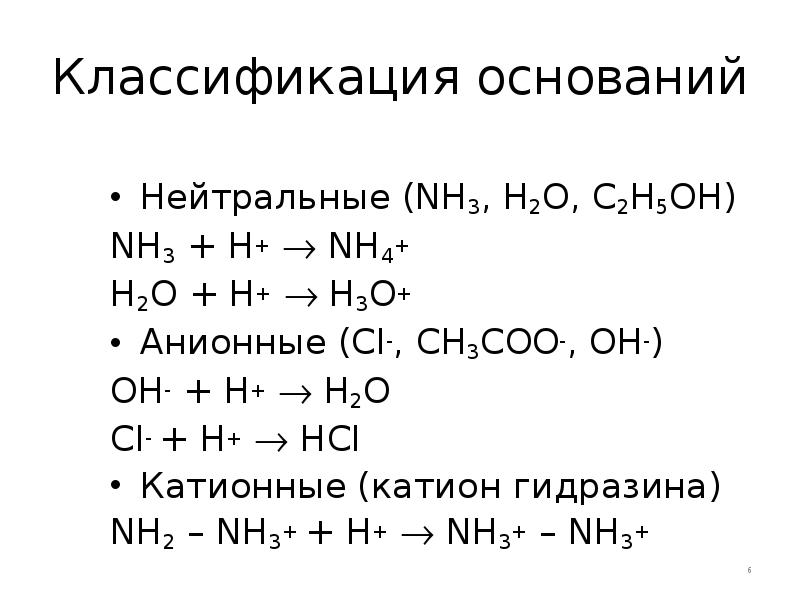
- 6. Классификация оснований Нейтральные (NH3, H2O, C2H5OH) NH3 + H+ NH4+
- 7. Сопряженная протолитическая пара HCI + NH3 = CI- + NH4+ HCI
- 8. Роль растворителя Растворитель влияет на проявление кислотных и основных свойств Протогенный
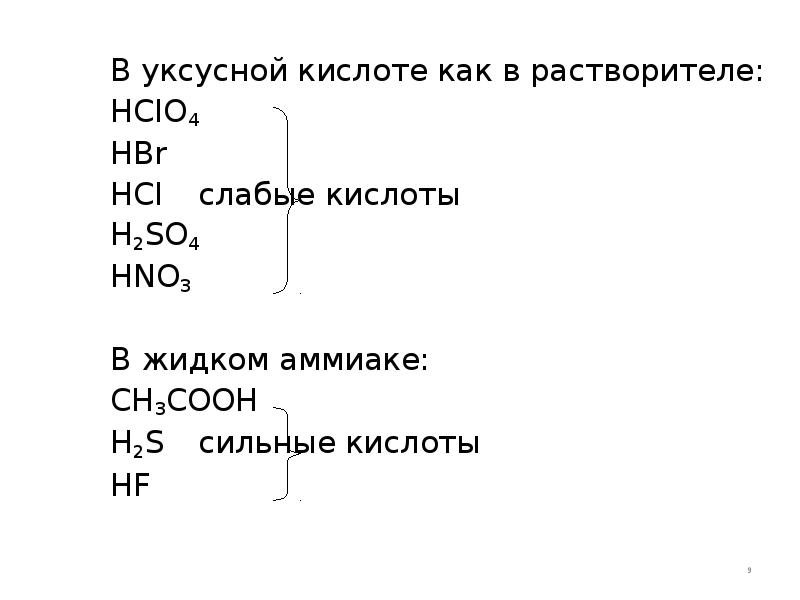
- 9. В уксусной кислоте как в растворителе: В уксусной кислоте как в
- 10. Протолитические реакции Диссоциации Нейтрализации Гидролиза
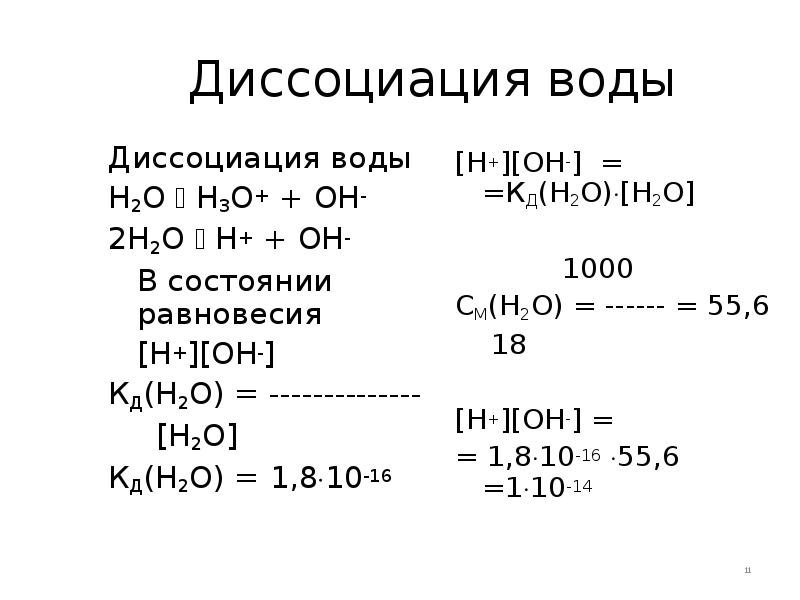
- 11. Диссоциация воды Диссоциация воды H2O H3O+ + OH- 2H2O
- 12. Ионное произведение воды Величина постоянная для растворов кислот, оснований и солей
- 13. Водородный показатель рН = - lg [H+] Если [H+] = 110-5;
- 14. Кислотность Активная – концентрация ионов водорода в растворе CH3COOH H+
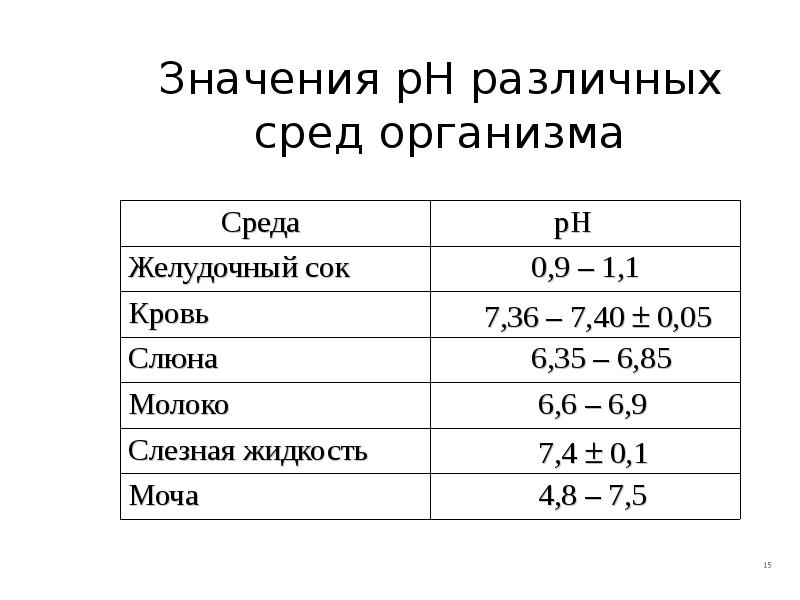
- 15. Значения рН различных сред организма
- 16. Роль активной реакции среды Определяет активность ферментов Действие клеточных мембран Устойчивость
- 17. Методы определения рН Колориметрический – основан на изменении цвета раствора в
- 18. Индикаторы Сложные органические вещества, которые в химическом плане представляют собой слабые
- 19. Теория Оствальда HInd – индикатор-кислота IndOH – индикатор-основание HInd H+
- 20. Изменение окраски индикатора Метилрот Кислота H+: HInd H+ + Ind-
- 21. Диссоциация индикатора Индикаторы – слабые электролиты [H+][Ind-] Кд = -------------
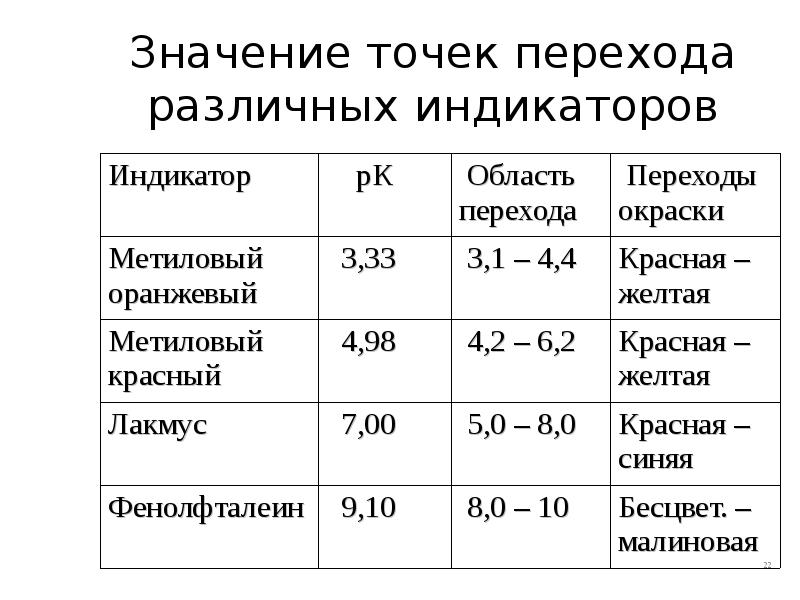
- 22. Значение точек перехода различных индикаторов
- 23. Зона перемены окраски индикатора Та область значений рН, в которой происходит
- 24. Универсальный индикатор Смеси различных индикаторов с разными, но примыкающими друг к
- 25. Безбуферный метод определения рН (метод Михаэлиса) Основан на использовании набора одноцветных
- 26. Буферный метод определения рН Основан на сравнении окраски индикатора в исследуемом
- 27. Недостатки колориметрического метода Трудность определения рН мутных и окрашенных растворов Субъективные
- 28. Скачать презентацию








![Водородный показатель
рН = - lg [H+]
Если [H+] = 110-5; Водородный показатель
рН = - lg [H+]
Если [H+] = 110-5;](/documents_3/309615f1172ae41e268e546524de5f37/img12.jpg)






![Диссоциация индикатора
Индикаторы – слабые электролиты
[H+][Ind-]
Кд = -------------
Диссоциация индикатора
Индикаторы – слабые электролиты
[H+][Ind-]
Кд = -------------](/documents_3/309615f1172ae41e268e546524de5f37/img20.jpg)





Слайды и текст этой презентации
Скачать презентацию на тему Протолитическая теория кислот и оснований можно ниже:
Похожие презентации





























