Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) презентация
Содержание
- 2. 1. Основные понятия и характеристики 1. Основные понятия и характеристики 2.
- 3. Дисперсные системы - это смеси различных веществ. Они состоят из диспергированных
- 4. В зависимости от размера частиц дисперсные системы подразделяются на группы: В
- 5. Истинные растворы – Истинные растворы – содержат атомы и
- 6. Раствором называют гомогенную систему переменного состава, состоящую из одного или нескольких
- 7. Растворитель- это тот компонент агрегатное состояние, которого не изменяется при образовании
- 8. Мера растворимости характеризуется коэффициентом растворимости – Мера растворимости характеризуется коэффициентом
- 9. Если К < 10–3 г/100 г воды – тогда вещество называется нерастворимым “н”
- 10. Для малорастворимых “м” и растворимых “р” веществ значение растворимости при различных
- 11. Произведение растворимости (ПР) – это та часть вещества которая растворилась и
- 12. ПР Аl(OH)3 = 1·10-32 ПР Аl(OH)3 = 1·10-32 Al(OH)3 → Al3+ + 3OH–
- 14. Растворение – это физико-химический процесс. Растворение – это физико-химический процесс. Физическая
- 15. Теплотой или энтальпией растворения – называется количество теплоты, которое выделяется или
- 16. а) разрушение структуры растворенного вещества, т.е. фазовый переход Нфп а) разрушение
- 17. б) гидратация б) гидратация Нгидр < 0 тепло выделяется Na+ + n·H2O = [Na(H2O)n]+ Cl– + m·H2O = Cl– •m·H2O H<0 S<0
- 18. в) Hраст = Hфп + Нгидр в) Hраст = Hфп + Нгидр Если Hфп > Нгидр – то процесс эндотермический, Если Hфп < Нгидр – то процесс
- 19. Энтропия растворения твердых и жидких веществ всегда больше нуля S>0 Энтропия
- 20. Gраств=Нраств+Т·Sраств Gраств=Нраств+Т·Sраств Gраств <0 – растворение идет самопроизвольно. G насыщенного
- 21. Насыщенный раствор – это раствор который находится в равновесии с растворяющимся
- 23. Концентрация раствора – это количество растворенного вещества, содержащегося в единице массы
- 24. Молярная концентрация – характеризует число молей растворенного вещества в одном литре
- 25. m (р.в.) - масса растворенного вещества, г; m (р.в.) - масса
- 26. Молярная концентрация эквивалента или нормальность – выражает число моль эквивалентов в
- 27. Моляльная концентрация – число моль растворенного вещества на 1 кг растворителя
- 28. Мольная доля – характеризуется отношением числа молей компонента к общему числу
- 29. Массовая доля – это число единиц массы растворенного вещества содержащееся в
- 30. Титр раствора – масса растворенного вещества в 1 мл раствора Титр
- 32. Идеальные растворы – это такие растворы, образование которых происходит без изменения
- 33. В идеальных растворах частицы растворенного вещества находятся на большом расстоянии друг
- 34. Разбавленные растворы приближаются к идеальным. Разбавленные растворы приближаются к идеальным. Из
- 35. Растворы не проводящие электрический ток называются неэлектролитами. Растворы не проводящие электрический
- 36. Некоторые физические свойства растворов неэлектролитов зависят только от концентрации частиц растворенного
- 37. К коллигативным свойствам относятся следующие: К коллигативным свойствам относятся следующие: Понижение
- 38. Согласно, первому закону Рауля – относительное понижение давления насыщенного пара растворителя
- 39. Р0 – давление насыщенного пара над чистым растворителем; Р0 – давление
- 40. Вычислить давление пара раствора содержащего 45г глюкозы C6H12O6 в 720 граммах
- 41. Второй закон Рауля: Второй закон Рауля: а) Повышение температуры кипения Ткип
- 42. Екип – это моляльная константа повышения температуры кипения растворителя или его
- 43. Вычислить температуру кипения 4,6% раствора глицерина в воде. Молекулярная масса глицерина
- 44. Второй закон Рауля: Второй закон Рауля: б) Понижение температуры затвердевания растворов
- 45. Кзатв – это моляльная константа понижения температуры затвердевания или криоскопическая константа
- 46. Вычислить температуру затвердевания раствора состоящего из 100 гр этиленгликоля С2Н6О2 (М=62)
- 47. Раствор представляет собой однородную систему. Раствор представляет собой однородную систему.
- 48. Молекулы растворителя и растворенного вещества будут диффундировать преимущественно в том направлении,
- 49. Однако диффузия бывает односторонней, если растворы разделить полупроницаемой перегородкой, пропускающей только
- 50. Для количественной характеристики осмотических свойств вводится понятие осмотического давления. Для
- 51. Вант –Гофф предложил, что для осмотического давления можно применять уравнение состояния
- 52. СМ – молярная концентрация раствора. Растворы с одинаковым осмотическим давлением называются
- 53. Вычислить осмотическое давление при 270 С раствора сахара С12Н22О11 (М=342) 1
- 55. Процесс распада вещества на ионы при растворении называется электролитической диссоциацией. Процесс
- 56. Cтепень электролитической диссоциации () - это количество распавшихся на ионы молекул
- 57. По величине различают: По величине различают: а) сильные электролиты > 0,3
- 58. При диссоциации в растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами
- 59. СН3СООН=СН3СОО– + Н+ СН3СООН=СН3СОО– + Н+ В водном растворе устанавливается равновесие которое количественно характеризуется константой
- 60. Обозначим концентрации каждого из ионов: Обозначим концентрации каждого из ионов:
- 61. Тогда константу диссоциации запишем: Тогда константу диссоциации запишем:
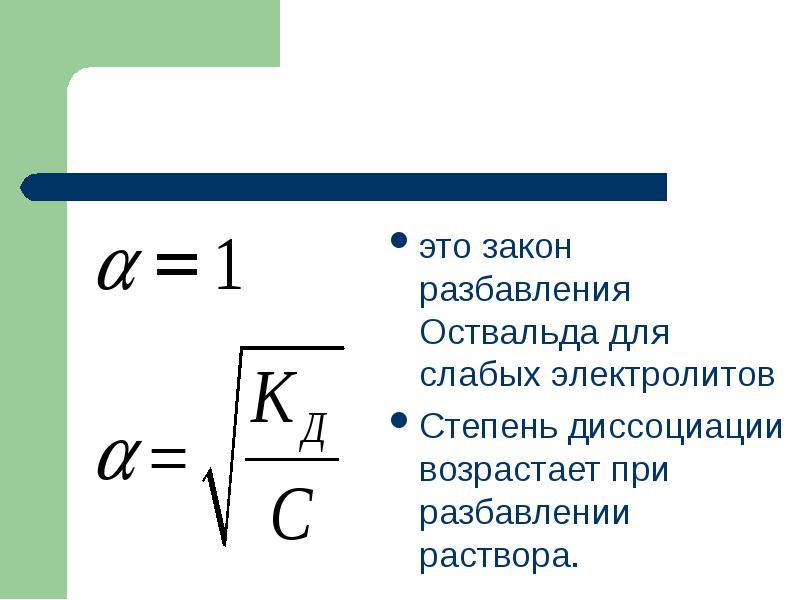
- 62. это закон разбавления Оствальда для слабых электролитов это закон разбавления
- 63. Сильные электролиты в растворе диссоциируют на ионы. Сильные электролиты в растворе
- 64. Серная кислота диссоциирует по двум ступеням: Серная кислота диссоциирует по двум
- 65. NaОH = Na+ + OH– NaОH = Na+ + OH–
- 66. KCI = K+ + CI– KCI = K+ + CI– Al2(SO4)3 = 2Al3+ + 3SO4 2–
- 67. Экспериментально определяемые для сильных электролитов степени диссоциации называют кажущимися (каж) Экспериментально
- 68. Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества
- 69. Это отношение общего числа частиц в растворе к числу растворенных молекул
- 70. Изотонический коэффициент (i) – показывает во сколько раз концентрация частиц в
- 71. Изотонический коэффициент ( i ) может быть вычислен как отношение Р,
- 72. Изотонический коэффициент ( i ) и степень электролитической диссоциации (
- 73. Вычислить осмотическое давление (170С) раствора Na2SO4 в 1 литре которого содержится
- 75. В насыщенном растворе малорастворимых соединений устанавливается равновесие между осадком и ионами
- 76. Произведение растворимости равно константе равновесия реакции, равно произведению молярных концентраций ионов
- 77. Ca3(PO4)2 = 3Ca2+ + 2PO43- Ca3(PO4)2 = 3Ca2+ + 2PO43- ПР=[Ca2+]3·[PO43-]2 =Kp
- 78. Растворимость гидроксида магния при 180С равна 1,7*10–4 моль/л. Найти произведение растворимости.
- 79. Произведение растворимости СаF2 =3,9·10–11. Какова растворимость СаF2 в воде( в г/литр
- 80. Условием образования осадка является превышение произведения концентраций ионов малорастворимого электролита над
- 81. Будет ли образовываться при смешении равных объемов нитрата свинца с концентрацией
- 82. Вода - слабый электролит Вода - слабый электролит Н2О
- 83. 1 л. H2O содержит 55,5 моль H2O 1 л. H2O
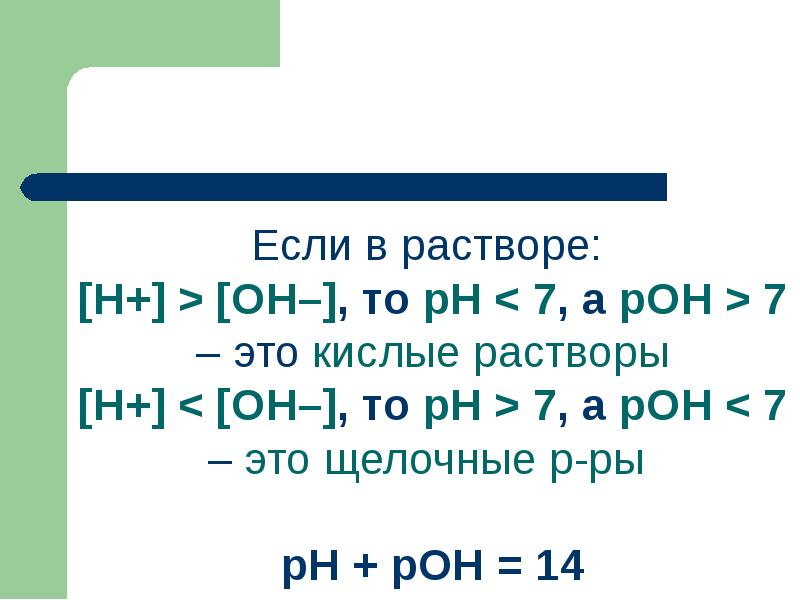
- 84. Кислотность или основность водных растворов характеризуется концентрацией [Н+] или [ОН–] ионов
- 86. Скачать презентацию
















![б) гидратация
б) гидратация
Нгидр < 0 тепло выделяется
Na+ + n·H2O = [Na(H2O)n]+
Cl– + m·H2O = Cl– •m·H2O H<0 S<0 б) гидратация
б) гидратация
Нгидр < 0 тепло выделяется
Na+ + n·H2O = [Na(H2O)n]+
Cl– + m·H2O = Cl– •m·H2O H<0 S<0](/documents_3/10cf93a9c18da15077497dff4573f2a3/img16.jpg)


























































![Ca3(PO4)2 = 3Ca2+ + 2PO43-
Ca3(PO4)2 = 3Ca2+ + 2PO43-
ПР=[Ca2+]3·[PO43-]2 =Kp Ca3(PO4)2 = 3Ca2+ + 2PO43-
Ca3(PO4)2 = 3Ca2+ + 2PO43-
ПР=[Ca2+]3·[PO43-]2 =Kp](/documents_3/10cf93a9c18da15077497dff4573f2a3/img76.jpg)






![Кислотность или основность водных растворов характеризуется концентрацией [Н+] или [ОН–] ионов
Кислотность или основность водных растворов характеризуется концентрацией [Н+] или [ОН–] ионов](/documents_3/10cf93a9c18da15077497dff4573f2a3/img83.jpg)
Слайды и текст этой презентации
Скачать презентацию на тему Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) можно ниже:
Похожие презентации





























