Растворы. Термодинамическая теория растворов презентация
Содержание
- 2. Теории растворов Корпускулярная теория (18 век). Раствор рассматривается как механическая смесь
- 3. Химическая теория (19 век, Менделеев). Растворение – разновидность химического взаимодействия между
- 4. Общая характеристика растворов. Раствор – термодинамически устойчивая гомогенная система переменного
- 5. Классификация растворов 1. По агрегатному состоянию: газообразные, жидкие, твердые. 2. По
- 6. 3. По концентрации: разбавленные, концентрированные, насыщенные, пересыщенные.
- 7. ПАРЦИАЛЬНЫЕ МОЛЬНЫЕ ВЕЛИЧИНЫ (ПМВ)
- 8. Раствор образован двумя или более компонентами, поэтому все его свойства являются
- 9. Парциальная мольная величина отражает изменение какого-либо экстенсивного свойства раствора при добавлении
- 11. Свойства ПМВ
- 13. ПМВ первого и второго рода
- 14. Методы определения ПМВ
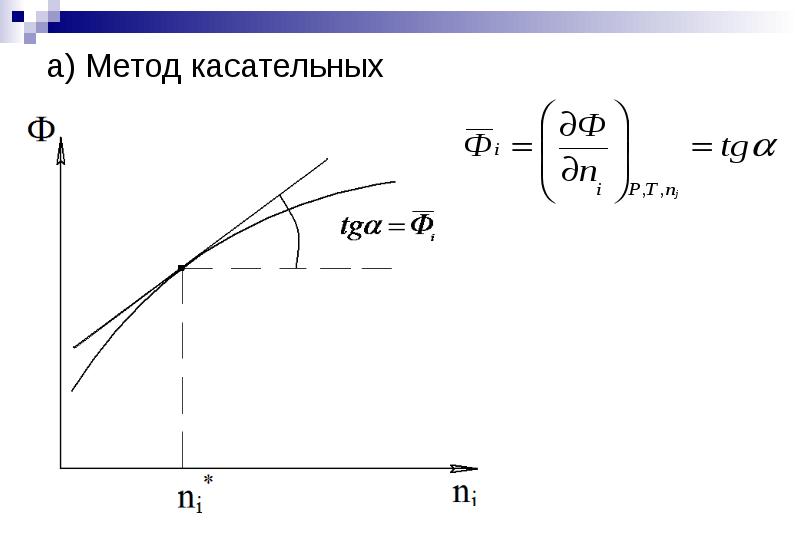
- 15. а) Метод касательных
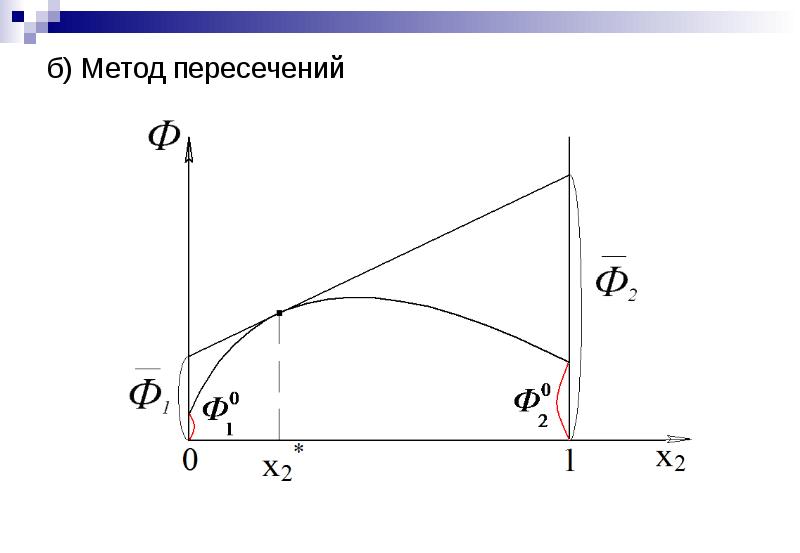
- 16. б) Метод пересечений
- 17. Парциальные мольные величины характеризуют не само свойство, а его изменение, поэтому
- 18. Уравнение Гиббса-Дюгема
- 21. Скачать презентацию


















Слайды и текст этой презентации
Скачать презентацию на тему Растворы. Термодинамическая теория растворов можно ниже:
Похожие презентации





























