Растворы высокомолекулярных веществ (ВМС) презентация
Содержание
- 2. План лекции Общие понятия Классификация полимеров Набухание ВМС Застудневание растворов ВМС
- 3. Биополимеры Природные высокомолекулярные соединения (ВМС), являющиеся структурной основой всех живых организмов
- 4. ВМС Большой молекулярный вес (104 < М
- 5. Классификация полимеров по происхождению Природные – встречаются в природе (натуральный каучук,
- 6. Типы пространственной структуры полимеров Линейные – химически не связанные одиночные цепи
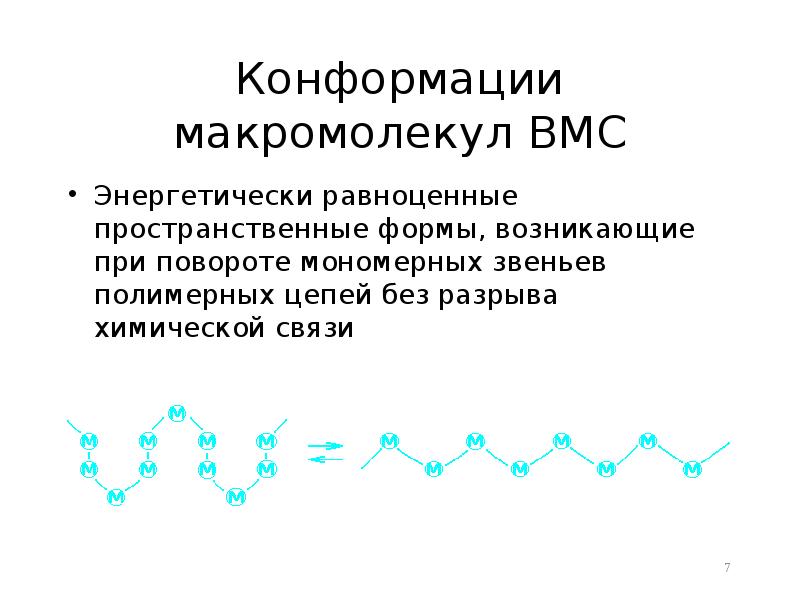
- 7. Конформации макромолекул ВМС Энергетически равноценные пространственные формы, возникающие при повороте мономерных
- 8. Растворы ВМС Самопроизвольно образующиеся гомогенные, однофазные, термодинамически устойчивые и обратимые, не
- 9. Набухание полимеров Увеличение объема и массы ВМС вследствие поглощения им растворителя.
- 10. Механизм набухания Первая стадия – за счет сольватации полярных групп ВМС
- 11. Группы полимеров по способности к набуханию Неограниченно набухающие – набухание идет
- 12. Факторы, влияющие на величину набухания Температура Степень измельчения полимера Возраст полимера
- 13. Ионы электролитов Чем сильнее ион гидратирован, тем сильнее он препятствует процессу
- 14. Реакция среды В кислой или щелочной среде : В результате адсорбции
- 15. Давление набухания Давление, которое оказывает набухающий полимер на ограничивающие его пористые
- 16. Студни (гели) Твердообразные нетекучие структурированные системы, возникающие в результате действия молекулярных
- 17. Получение студней Из растворов ВМС При набухании полимеров (столярный клей, сухой
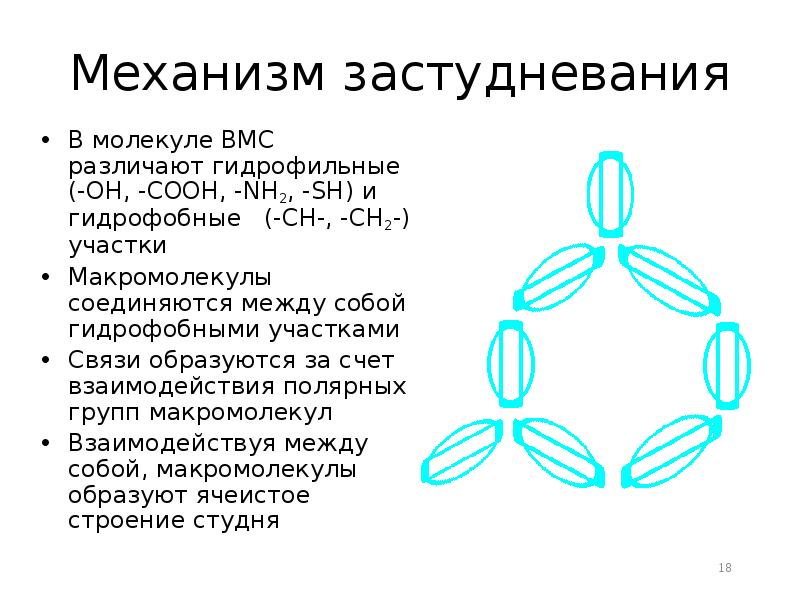
- 18. Механизм застудневания В молекуле ВМС различают гидрофильные (-OH, -COOH, -NH2, -SH)
- 19. Факторы, влияющие на скорость застудневания Концентрация Природа веществ Температура Время процесса
- 20. Время и форма частиц Период созревания – время, необходимое для образования
- 21. Электролиты Ускоряют застудневание (соли серной и уксусной кислот) Замедляют (хлориды и
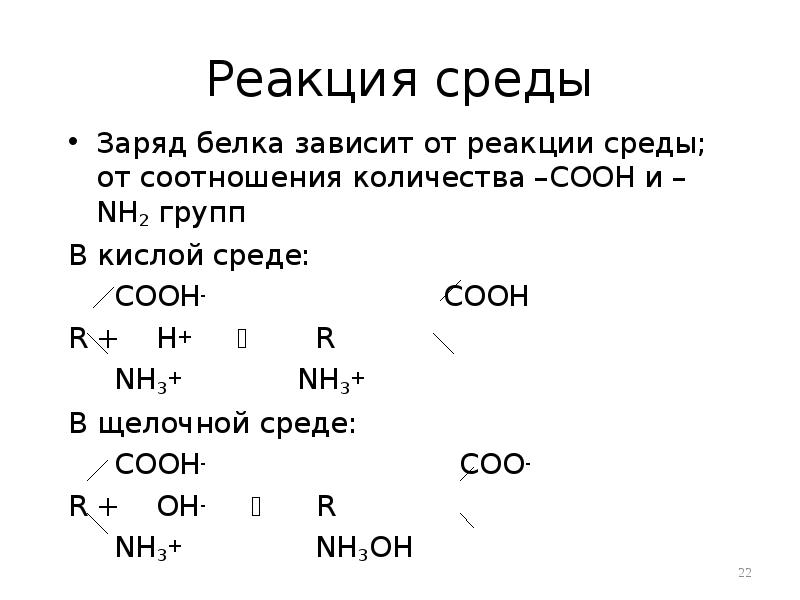
- 22. Реакция среды Заряд белка зависит от реакции среды; от соотношения количества
- 23. Изоэлектрическая точка Значение рН, при котором белок находится в изоэлектрическом состоянии
- 24. Тиксотропия. Синерезис Тиксотропия – обратимое превращение студня в раствор и наоборот
- 25. Особенности диффузии в студнях Диффузия крупных частиц и крупных молекул затруднена
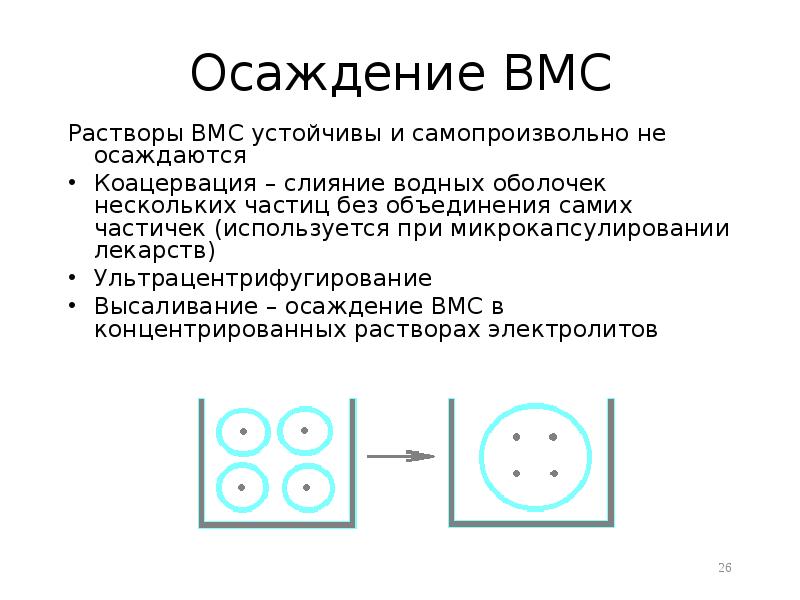
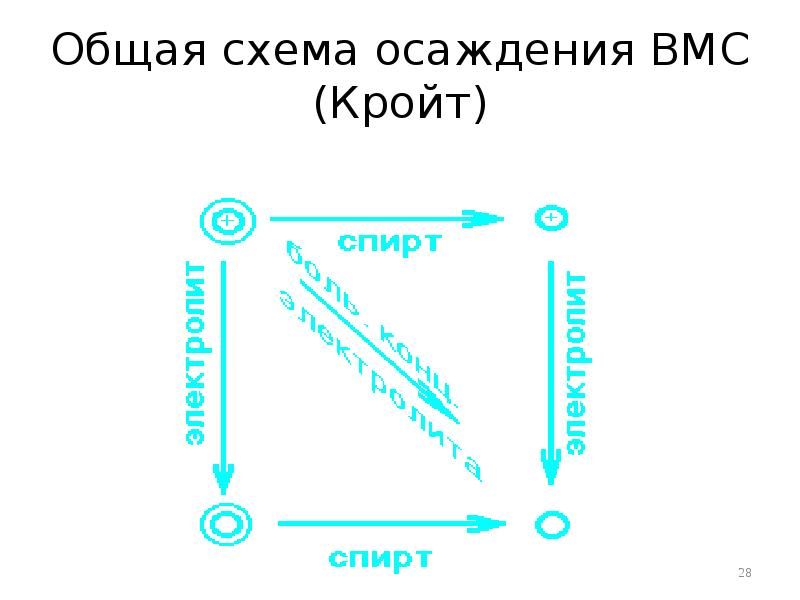
- 26. Осаждение ВМС Растворы ВМС устойчивы и самопроизвольно не осаждаются Коацервация –
- 27. Механизм высаливания Заключается в понижении растворимости ВМС в концентрированных растворах электролитов
- 28. Общая схема осаждения ВМС (Кройт)
- 29. Вязкость растворов ВМС Сопротивление жидкости при перемещении одной ее части относительно
- 30. Закон Ньютона dV F = S------- dX F –
- 31. Закон Пуазейля r4 Q = P------ 8l Q –
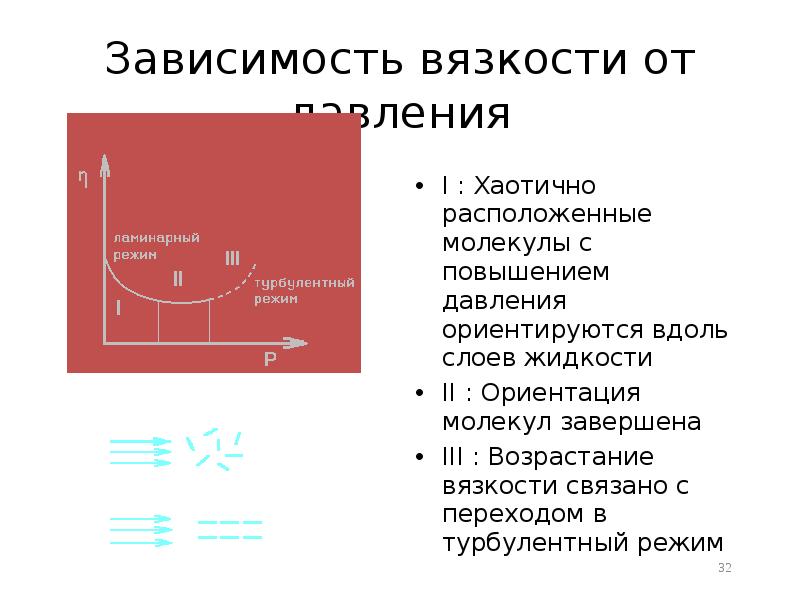
- 32. Зависимость вязкости от давления I : Хаотично расположенные молекулы с повышением
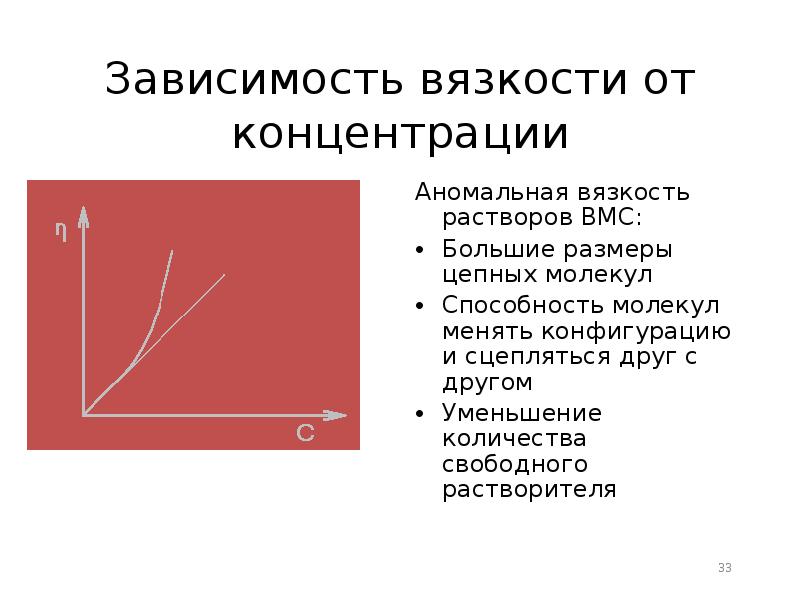
- 33. Зависимость вязкости от концентрации Аномальная вязкость растворов ВМС: Большие размеры цепных
- 34. Способы выражения вязкости Относительная отн = / 0
- 35. Уравнение Штаудингера Зависимость вязкости раствора ВМС от его концентрации и молекулярного
- 36. Определение молекулярной массы полимера Необходимо измерить вязкость растворителя 0 и вязкость
- 37. Вязкость крови Факторы, влияющие на вязкость крови: Концентрация Температура Давление Размер
- 38. Скачать презентацию






























Слайды и текст этой презентации
Скачать презентацию на тему Растворы высокомолекулярных веществ (ВМС) можно ниже:
Похожие презентации





























