Сопряжение. Ароматичность. Электронные эффекты заместителей презентация
Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об эффекте сопряжения,
- 3. Сопряжение В молекулах органических соединений возникают различные электронные эффекты, сопровождающиеся
- 4. Сопряжение В сопряженных системах возникает делокализованная связь, молекулярная орбиталь
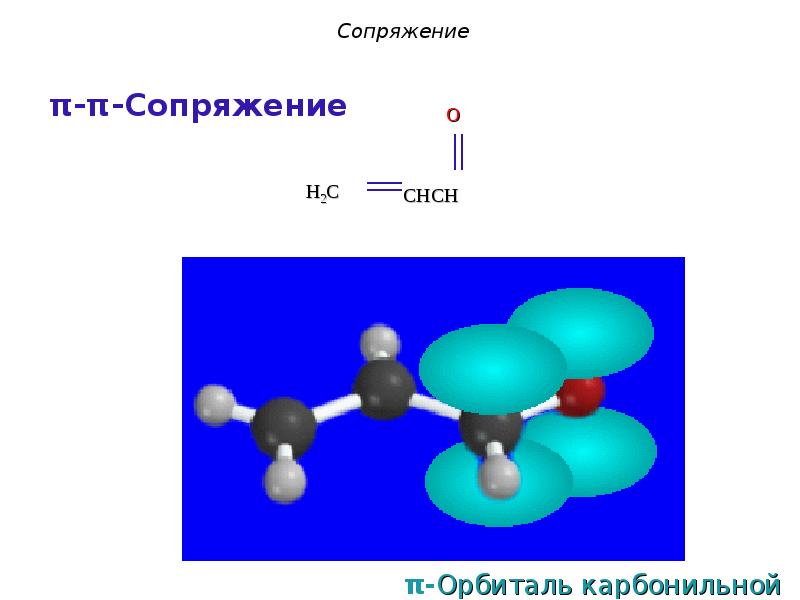
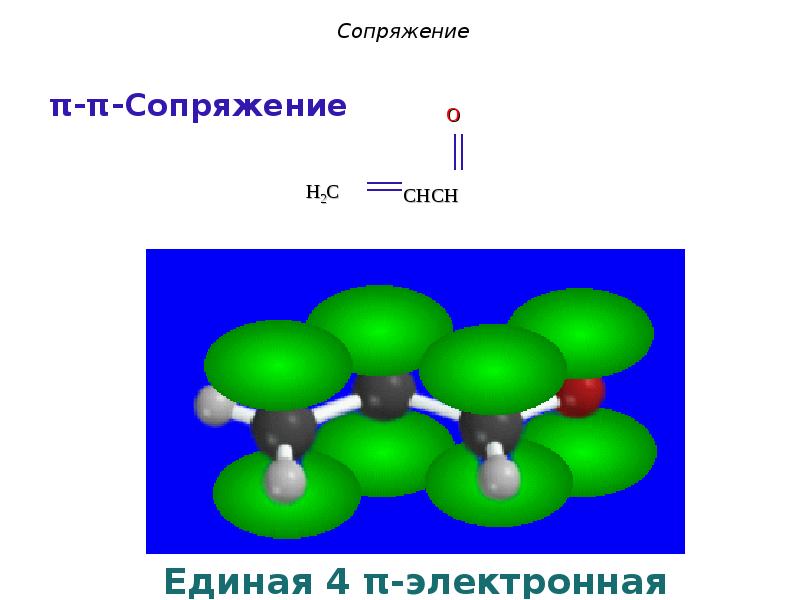
- 5. Сопряжение Различают 2 основных вида сопряжения: π-π-сопряжение
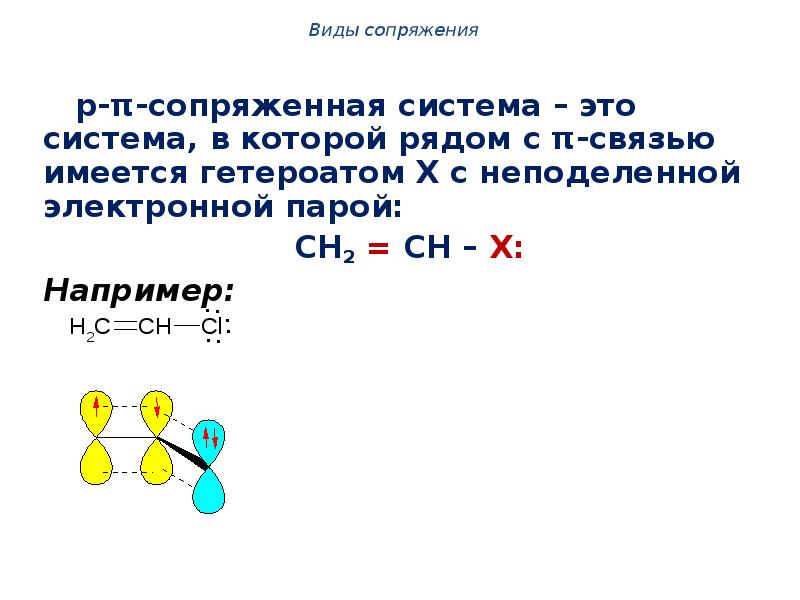
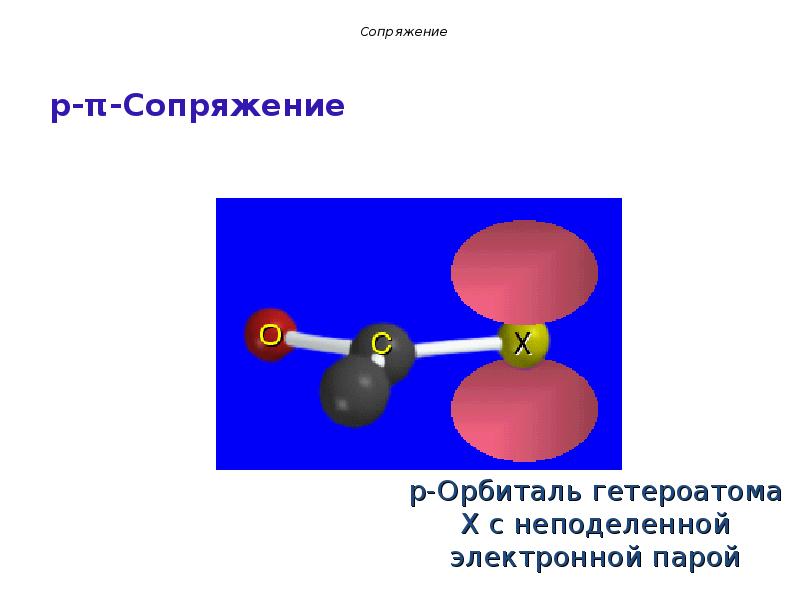
- 6. p-π-сопряженная система – это система, в которой рядом с π-связью имеется
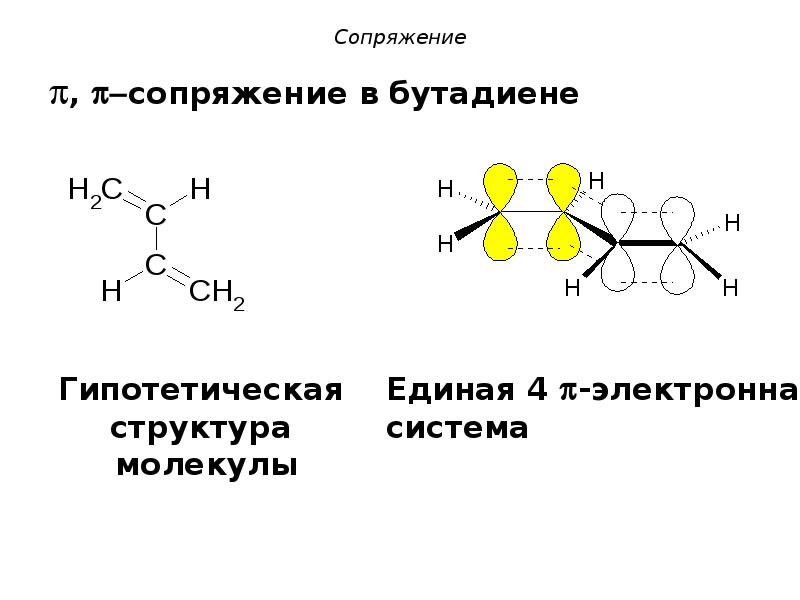
- 7. Сопряженная система бутадиен-1,3 Сопряженная система бутадиен-1,3 CH2=CH-CH=CH2 В молекуле
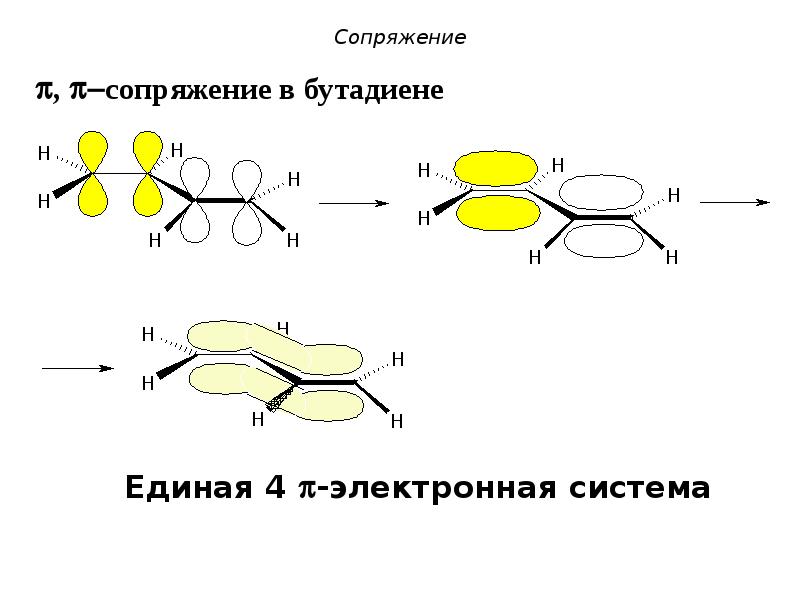
- 8. Сопряжение , сопряжение в бутадиене
- 9. Сопряжение
- 10. Сопряжение Почему изолированные двойные связи не находятся в сопряжении? -Связи
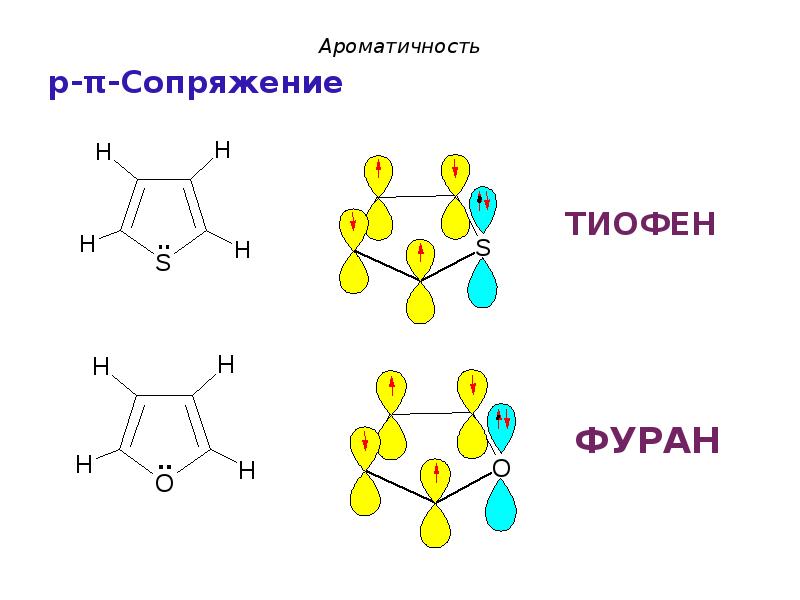
- 11. Сопряжение Система сопряжения может включать и гетероатом (О,
- 12. Сопряжение
- 13. Сопряжение
- 14. Сопряжение
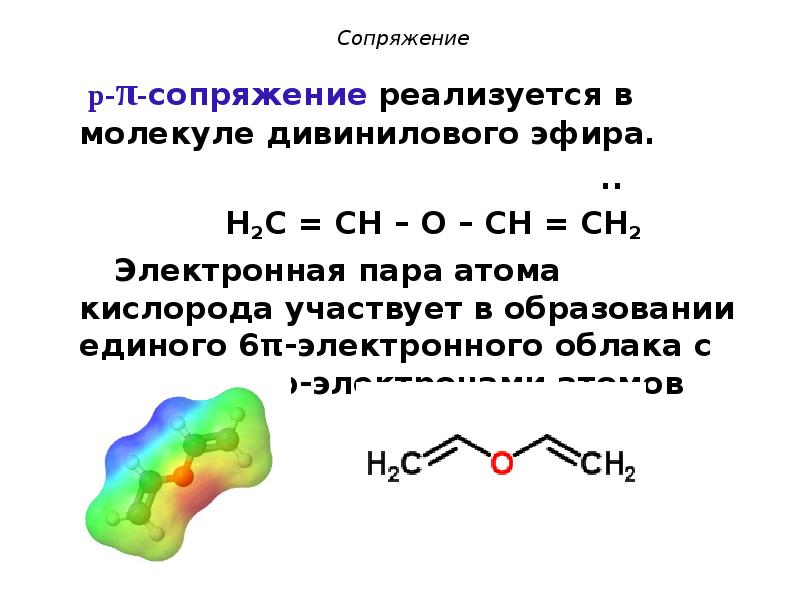
- 15. Сопряжение p-π-сопряжение реализуется в молекуле дивинилового эфира.
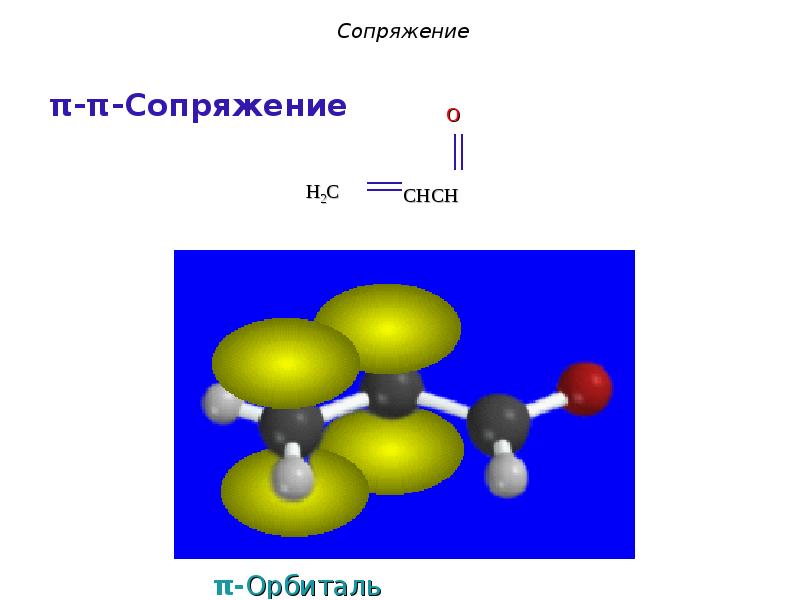
- 16. π-Орбиталь карбонильной группы π-Орбиталь карбонильной группы
- 17. p-Орбиталь гетероатома X с неподеленной электронной парой p-Орбиталь гетероатома X с
- 18. Единая 4π-электронная система Единая 4π-электронная система
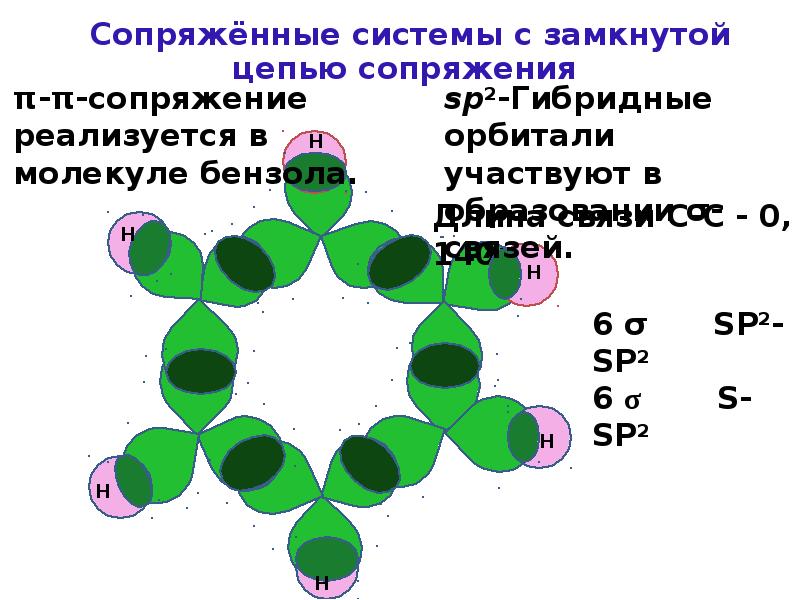
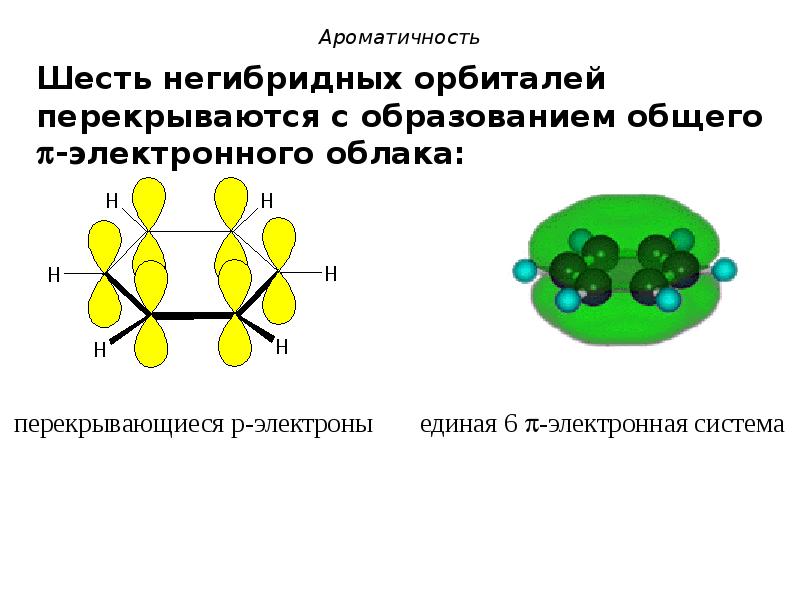
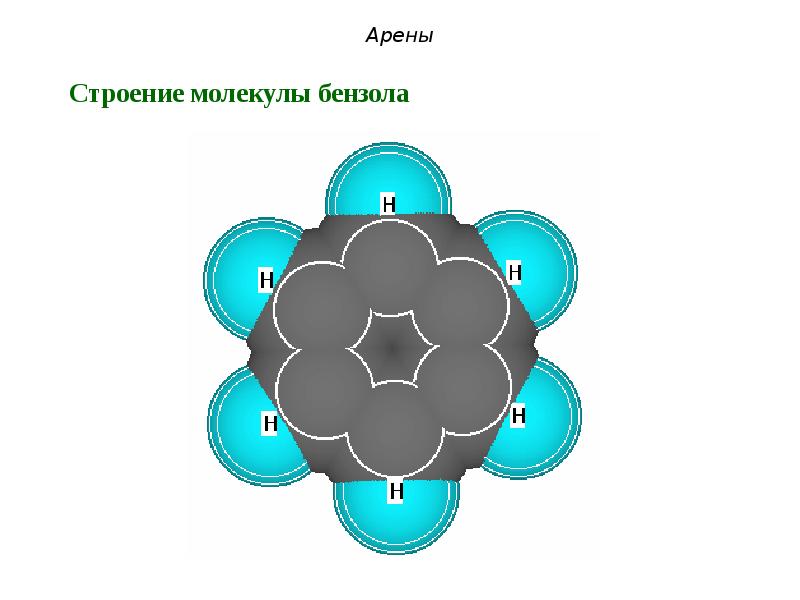
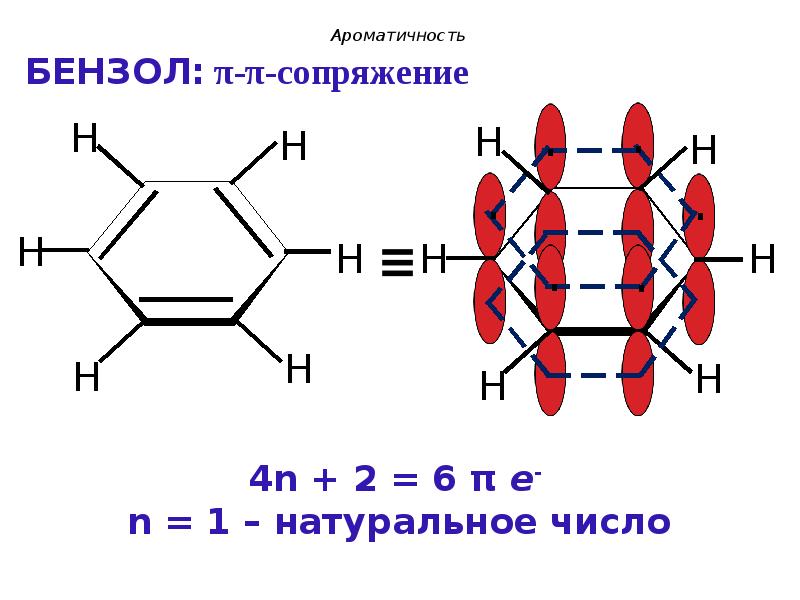
- 20. Ароматичность Шесть негибридных орбиталей перекрываются с образованием общего -электронного облака:
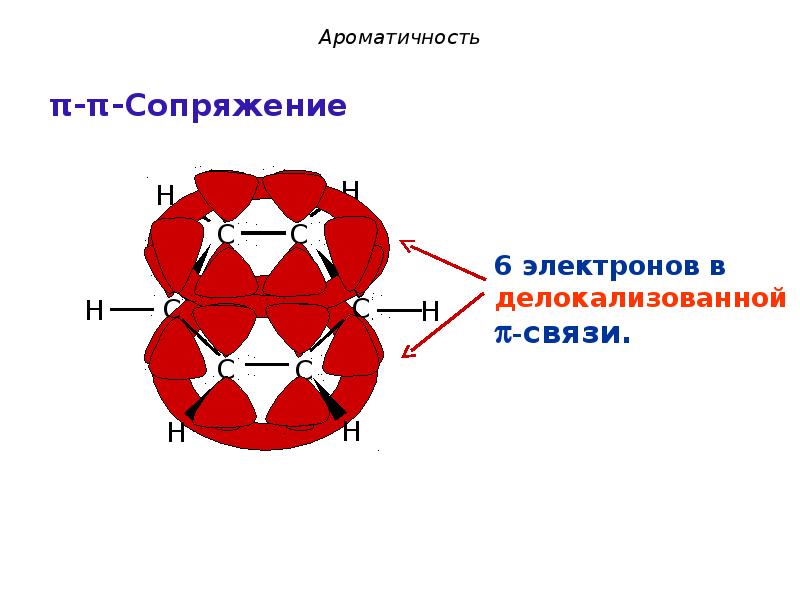
- 21. Ароматичность
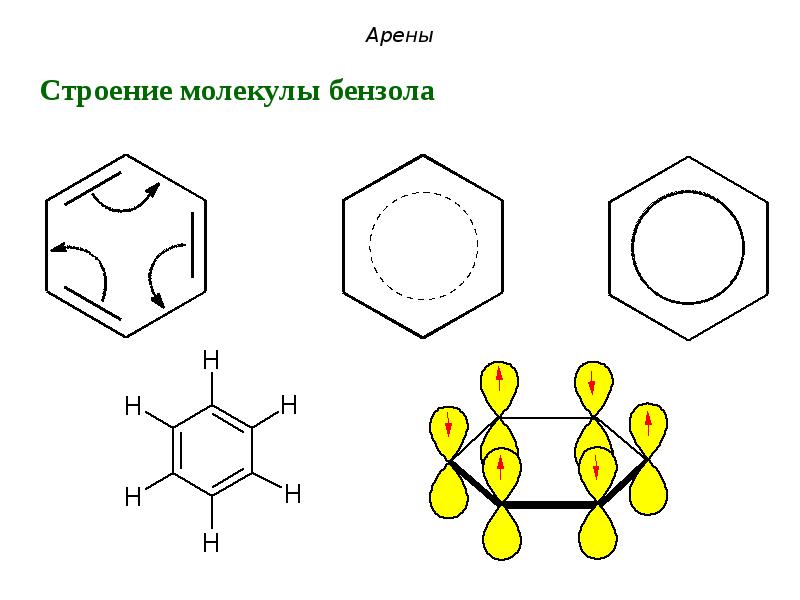
- 22. Арены
- 23. Арены
- 24. Ароматичность
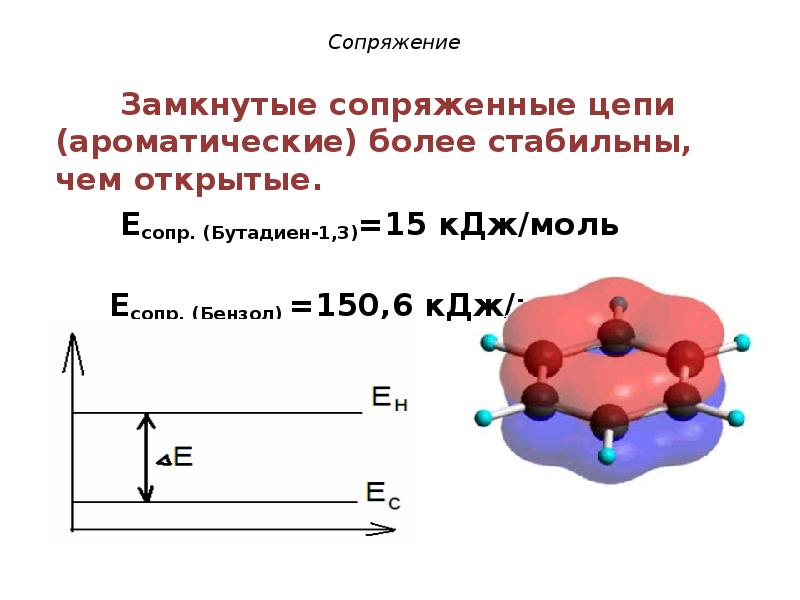
- 27. Устойчивость cопряженных систем О термодинамической устойчивости сопряженной системы
- 28. Сопряжение Замкнутые сопряженные цепи (ароматические) более стабильны, чем открытые.
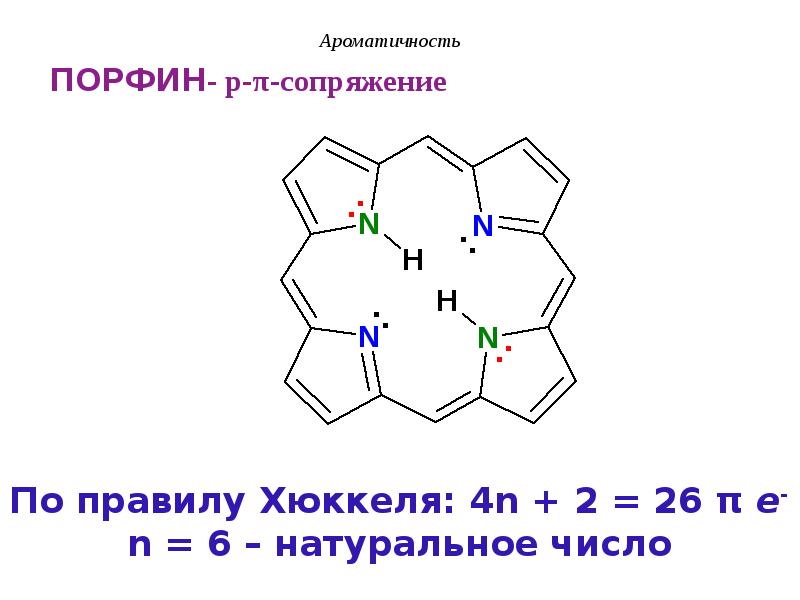
- 29. Ароматичность В циклических соединениях при определенных условиях может возникнуть замкнутая
- 30. Ароматичность
- 31. Ароматичность Критерии ароматичности (Хюккель, 1931г.): 1. Молекула имеет циклическое строение.
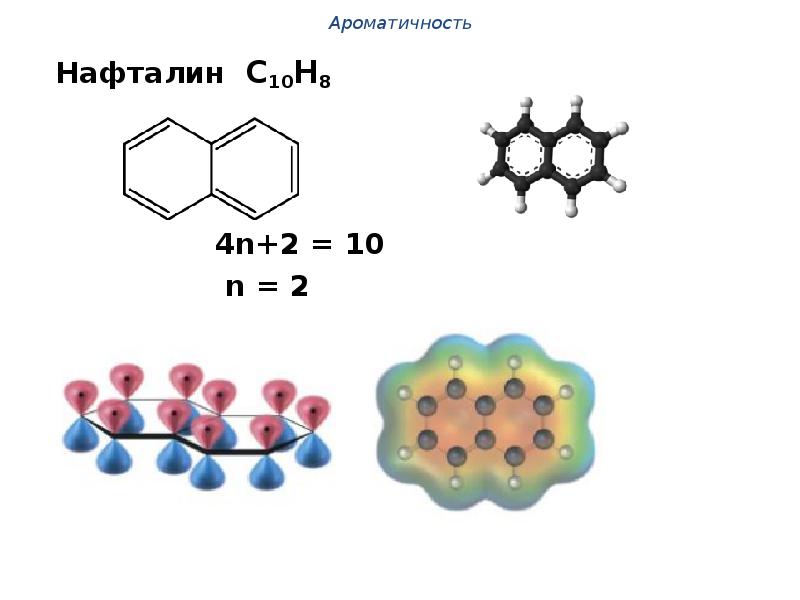
- 33. Нафталин С10Н8 Нафталин С10Н8
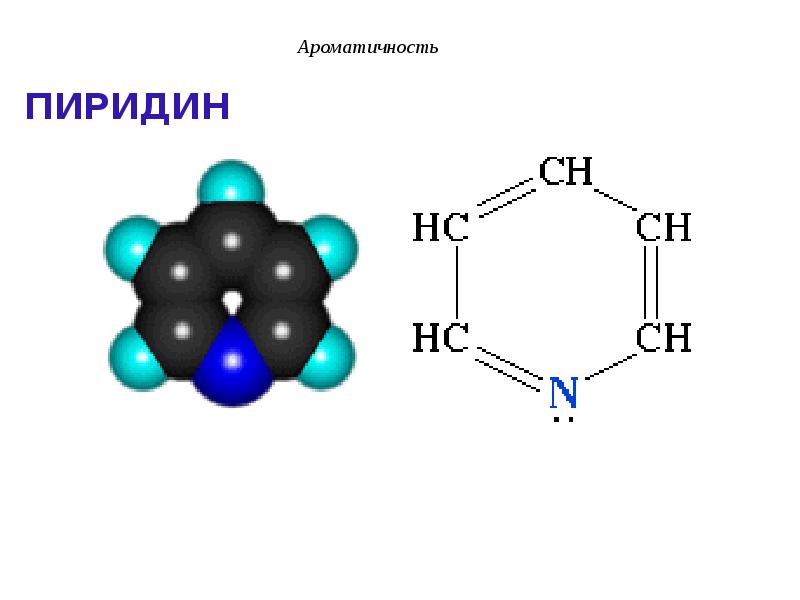
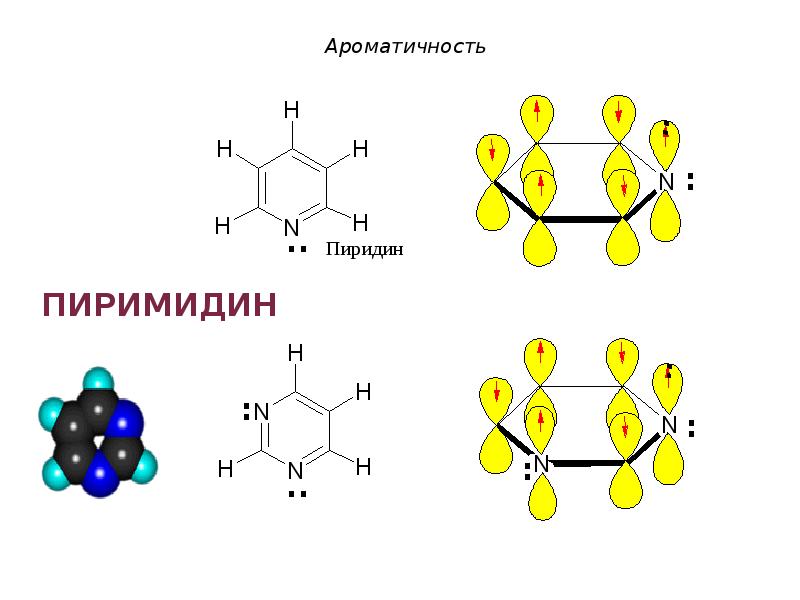
- 34. ПИРИДИН
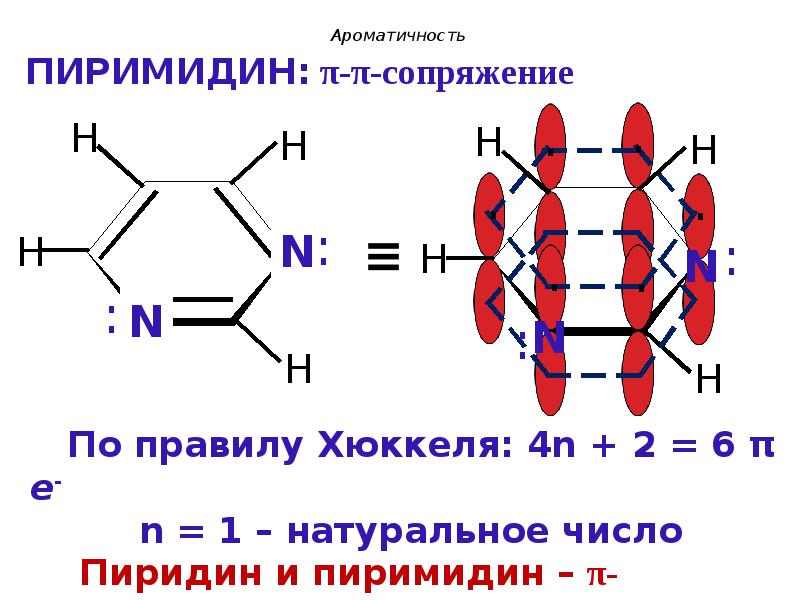
- 35. Ароматичность Пиридин отвечает критериям ароматичности: 1. Молекула имеет циклическое строение.
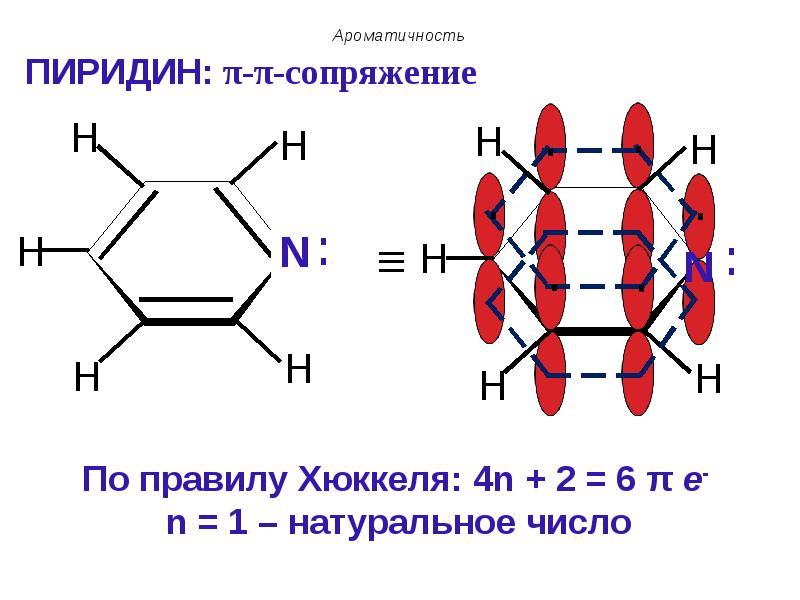
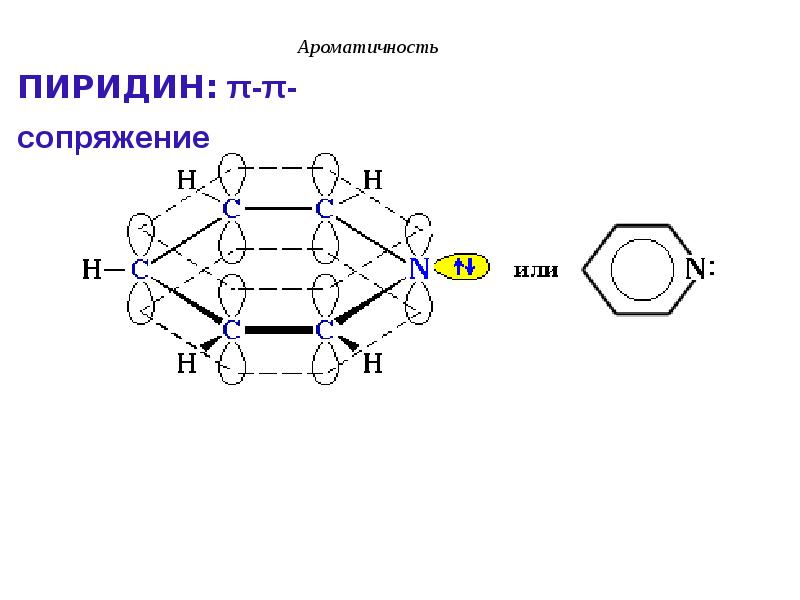
- 37. ПИРИДИН: π-π-сопряжение
- 38. Ароматичность Атом азота поставляет в сопряженную цепь один электрон и
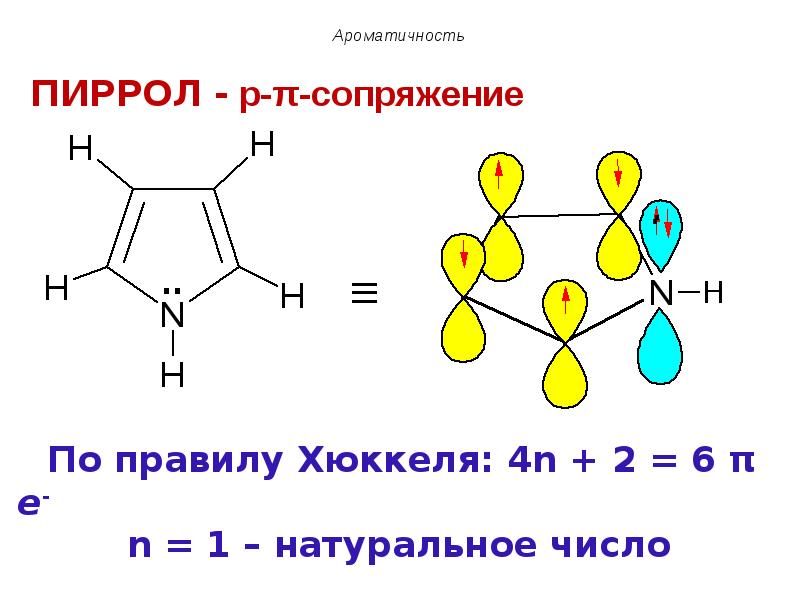
- 41. ПИРРОЛ - p-π-сопряжение
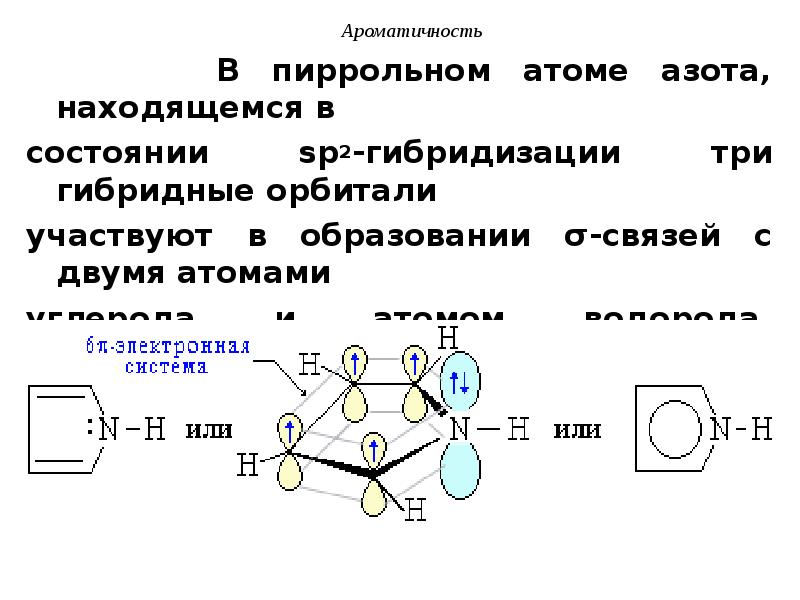
- 42. В пиррольном атоме азота, находящемся в В пиррольном атоме
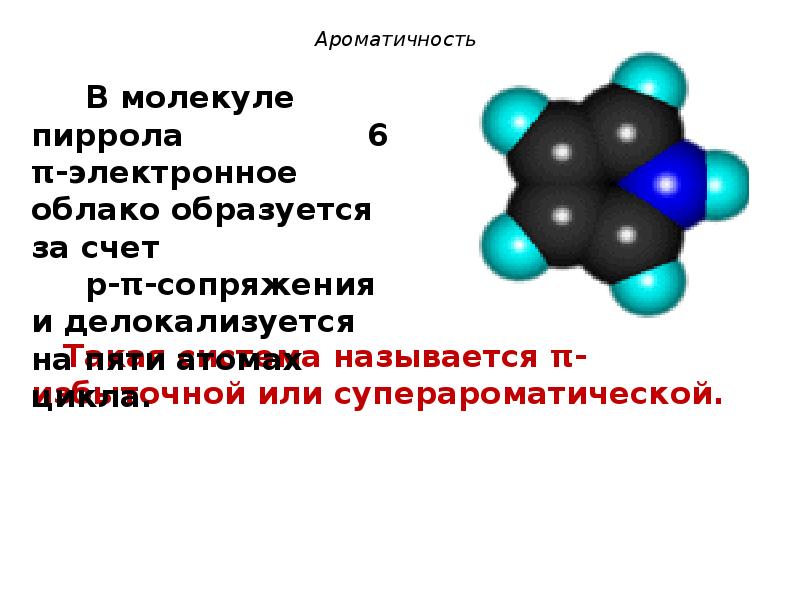
- 43. Ароматичность Такая система называется π-избыточной или суперароматической.
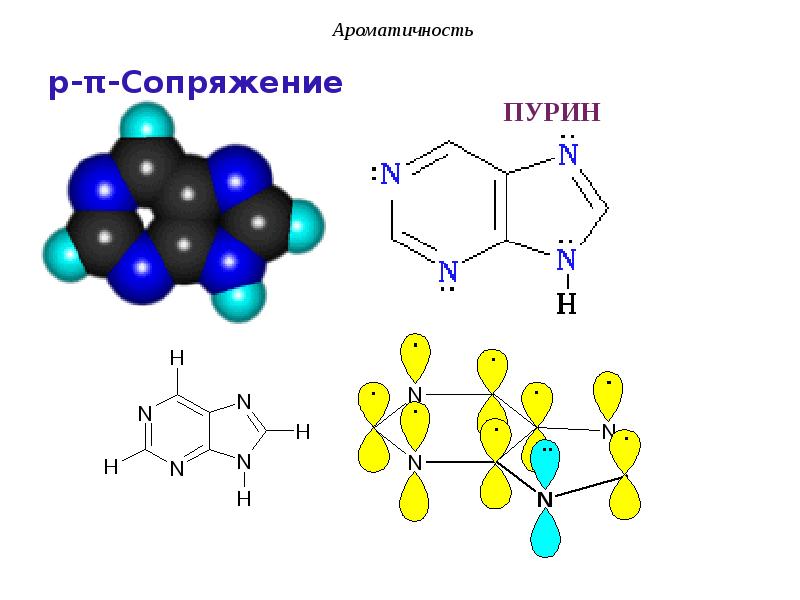
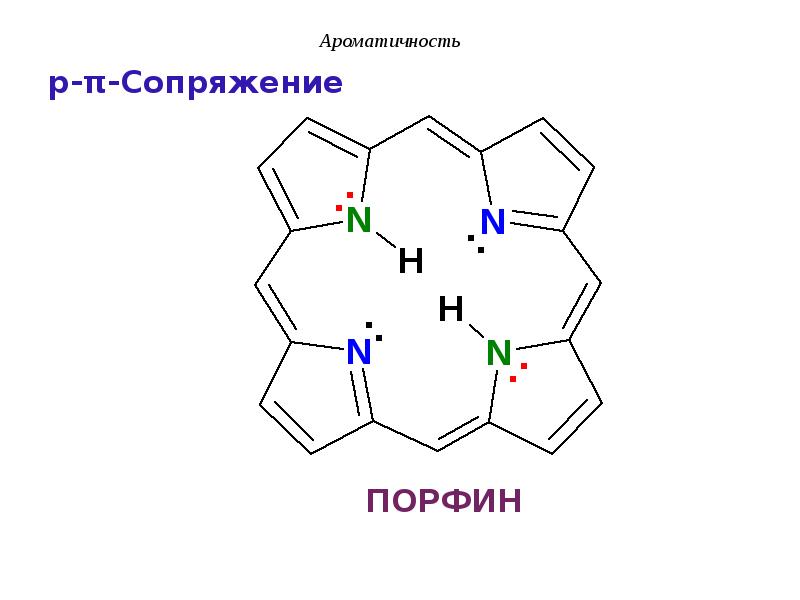
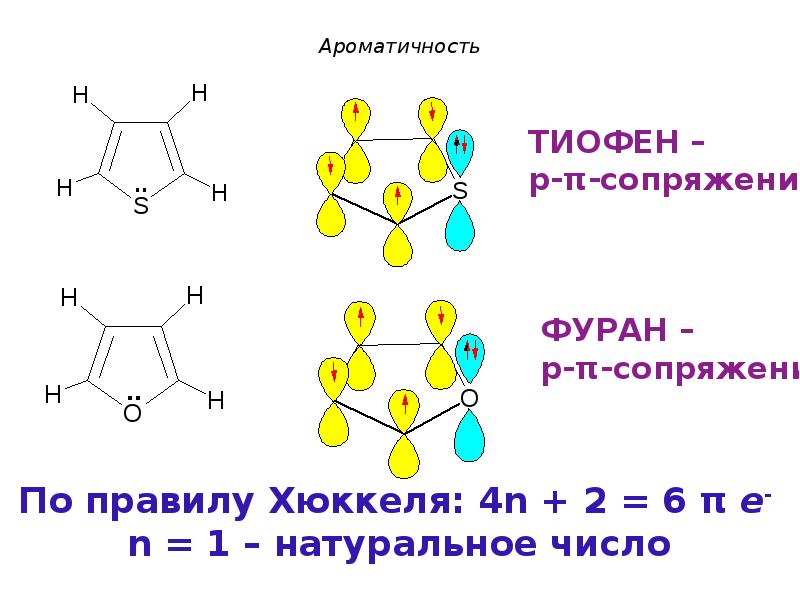
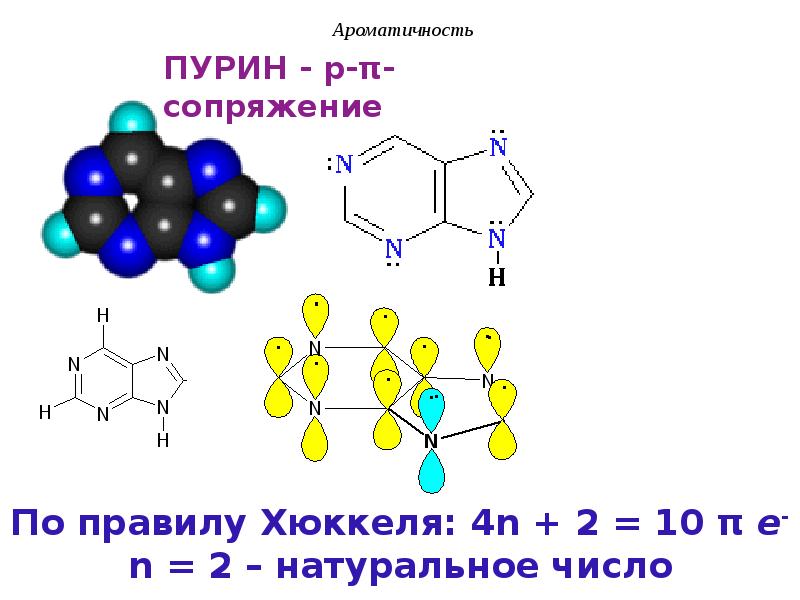
- 44. Ароматичность Таким образом в составе ароматических гетероциклических азотсодержащих структур
- 45. Ароматичность
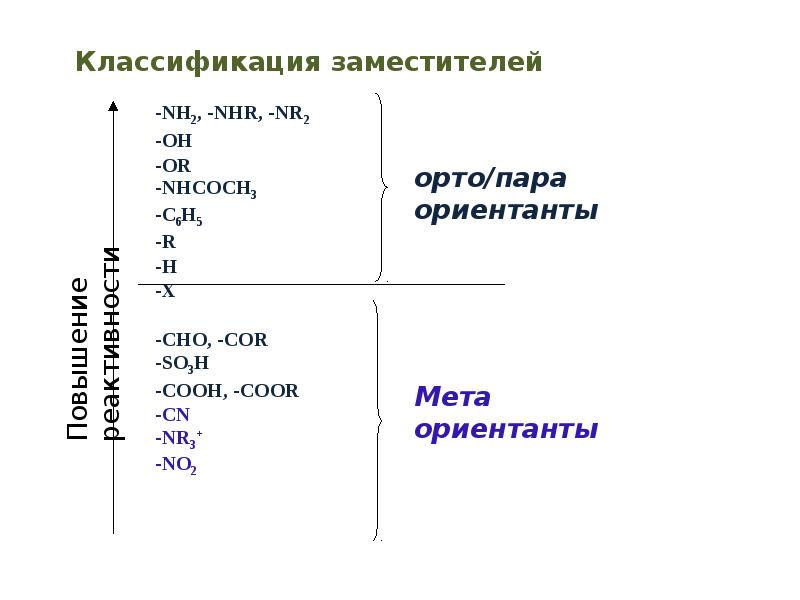
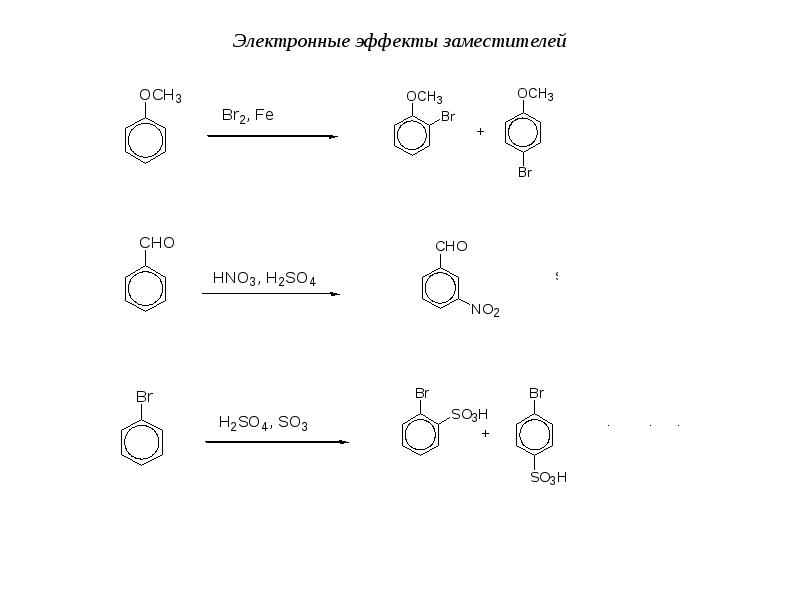
- 49. Электронные эффекты заместителей Индуктивный эффект обозначают буквой I и
- 50. Электронные эффекты заместителей –I эффект проявляют заместители, которые содержат
- 51. Электронные эффекты заместителей +I эффект проявляют заместители, содержащие атомы
- 52. Электронные эффекты заместителей Мезомерный эффект – смещение электронной плотности
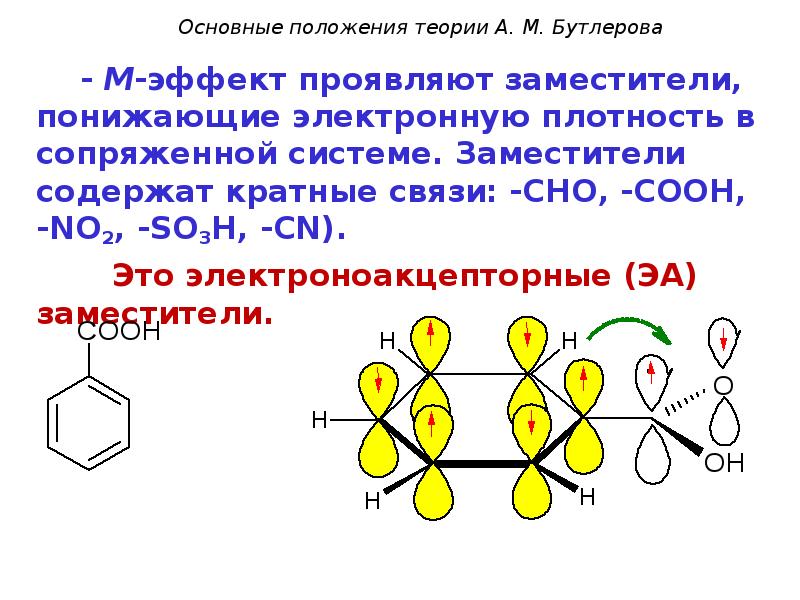
- 53. - М-эффект проявляют заместители, понижающие электронную плотность в сопряженной системе. Заместители
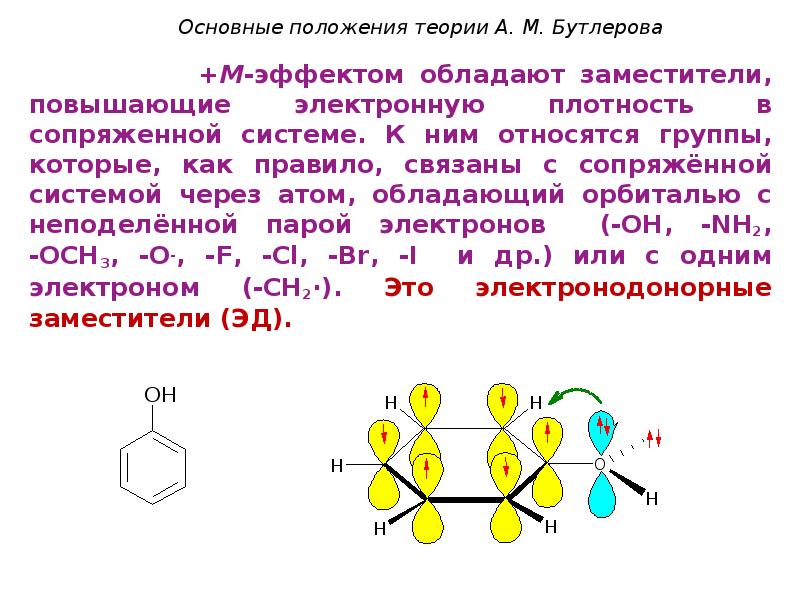
- 54. +М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним
- 55. Электронные эффекты заместителей Графически действие мезомерного эффекта изображают изогнутой
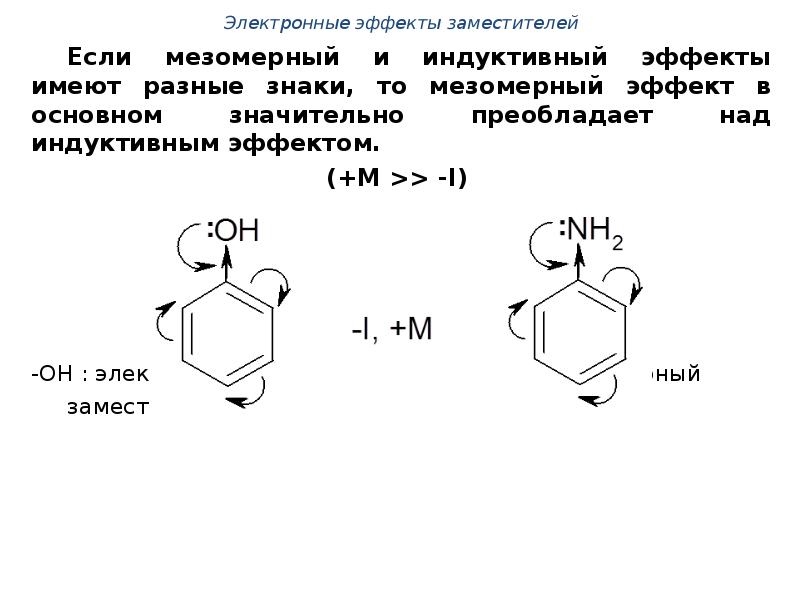
- 56. Если мезомерный и индуктивный эффекты имеют разные знаки, то мезомерный эффект
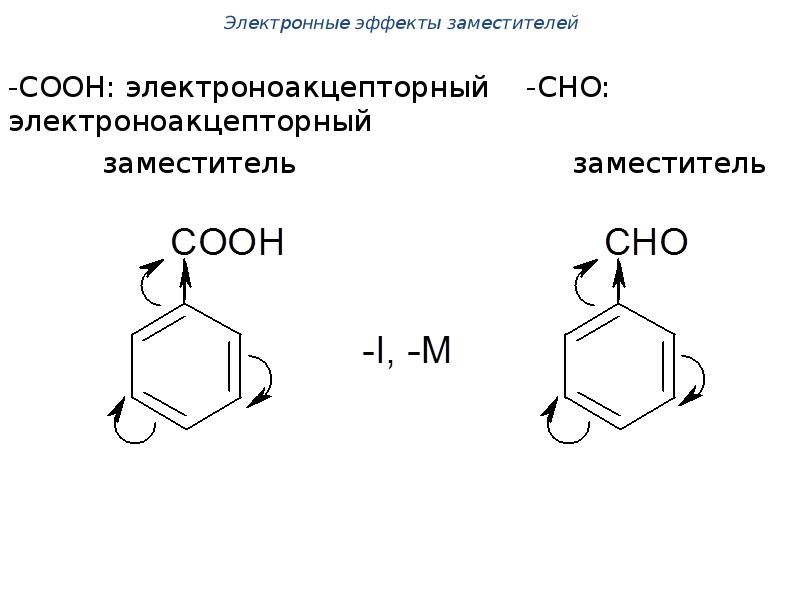
- 57. -СООН: электроноакцепторный -СНО: электроноакцепторный заместитель
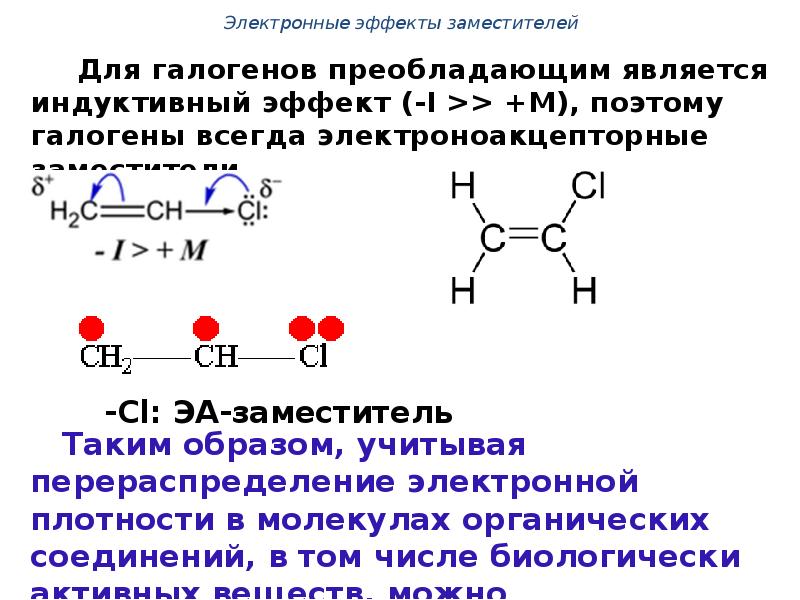
- 58. Для галогенов преобладающим является индуктивный эффект (-I >> +M), поэтому галогены
- 61. СПАСИБО ЗА ВАШЕ ВНИМАНИЕ! СПАСИБО ЗА ВАШЕ ВНИМАНИЕ!
- 62. Скачать презентацию
























Слайды и текст этой презентации
Скачать презентацию на тему Сопряжение. Ароматичность. Электронные эффекты заместителей можно ниже:
Похожие презентации





























