Сульфатна кислота і сульфати презентация
Содержание
- 2. Мета: Відновити знання про склад, фізичні властивості і відношення до води
- 3. Демонстрації: 5. Спалювання сірки і доведення кислотного характеру утвореного оксиду. 6.
- 4. Сульфатна кислота. Сульфатна, або сірчана, кислота їїформула — H2SO4. Будова
- 5. Укажіть значення валентності та ступеня окиснення Сульфуру в сульфатній кислоті. Укажіть
- 6. Фізичні властивості. За звичайних умов чиста сульфатна кислота — безбарвна оліїста
- 7. Переконатися в тому, що розчинення сульфатної кислоти — процес екзотермічний, допоможе
- 8. Потрібно знати Розчинення кислоти у воді супроводжується виділенням великої кількості теплоти.
- 9. Вона взаємодіє з: Вона взаємодіє з: 1)металами, розміщеними в
- 10. Хімічні властивості. Сульфатна кислота завдяки наявності в молекулі двох ковалентт них
- 11. Реакції з металами. взаємодіє майже з усіма металами. Можливість цих реакцій,
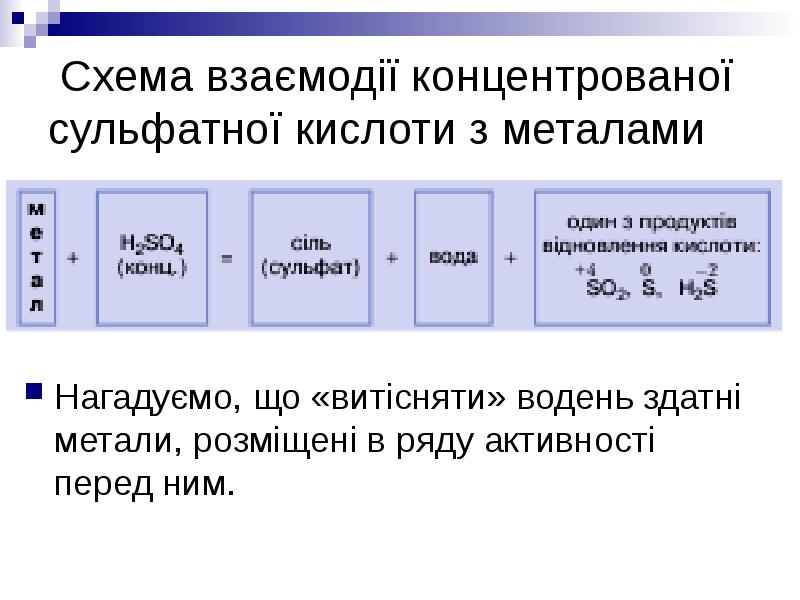
- 12. Схема взаємодії концентрованої сульфатної кислоти з металами Нагадуємо, що «витісняти» водень
- 13. Із розбавленою сульфатною кислотою не реагують мідь а), ртуть, золото, платина,
- 14. Малоактивні метали відновлюють Малоактивні метали відновлюють
- 15. Якщо в холодну концентровану сульфатну кислоту занурити кусочок заліза, то ми
- 16. Реакції зі складними речовинами. Сульфатна кислота взаємодіє з основними оксидами амфотерними
- 17. Будучи нелеткою і сильною кислотою, вона вступає в реакції обміну з
- 18. Розклад цукру і целюлози під дією сульфатної кислоти
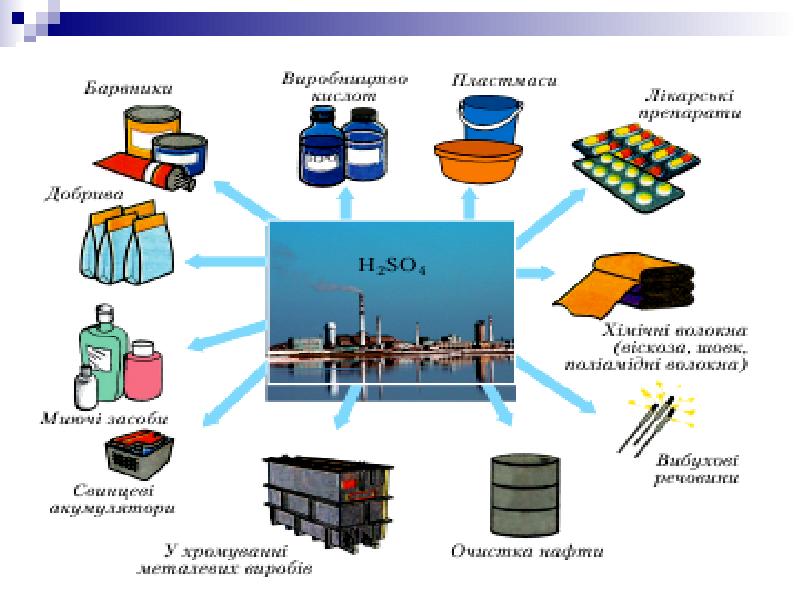
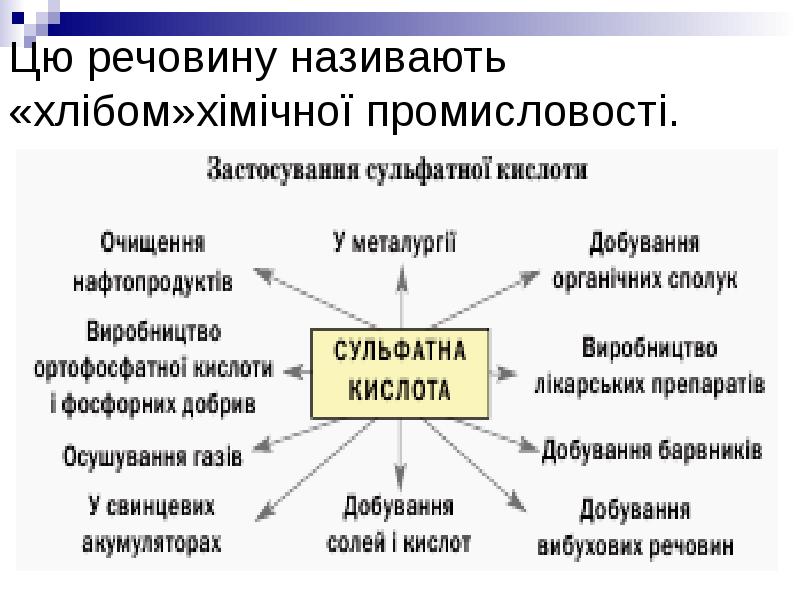
- 20. Цю речовину називають «хлібом»хімічної промисловості.
- 21. Сульфати. Сульфатна кислота утворює солі, загальна назва яких — сульфати Більшість
- 23. Найважливіші природні сульфати гіпсСаSO4·2Н2О; глауберова сільNa2SO4·10H2О; гірка сільMgSO4·7H2О. Із наведених
- 25. Глауберову сіль Na2SO4·10H2О застосовують у виробництві скла, соди, фарб, у медицині.
- 28. Якісною реакцією на сульфат аніони є взаємодія їх з катіонами Барію
- 29. Охорона навколишнього середовища від забруднення викидами сульфуровмісних речовин. Охорона навколишнього середовища
- 31. Поняття про кислотні дощі та причини їх виникнення. Чи доводилося вам
- 32. Фізіологічна дія гідроген сульфіду проявляється в тому, що він блокує дихальний
- 33. Охорона навколишнього середовища полягає насамперед у зменшенні викидів, а отже, у
- 34. З якими з перелічених речовин взаємодіє розбавлена сульфатна кислота: залізо, купрум(ІІ)
- 35. Ознайомтеся з виданими вам зразками Ознайомтеся з виданими вам зразками сульфатів
- 36. ВИСНОВКИ Сульфатна кислота H2SO4 — безбарвна оліїста рідина без запаху, яка
- 37. Скачать презентацию
































Слайды и текст этой презентации
Похожие презентации