Термохимия. Расчет тепловых эффектов химических реакций презентация
Содержание
- 2. Закон Гесса.
- 3. Применение закона Гесса
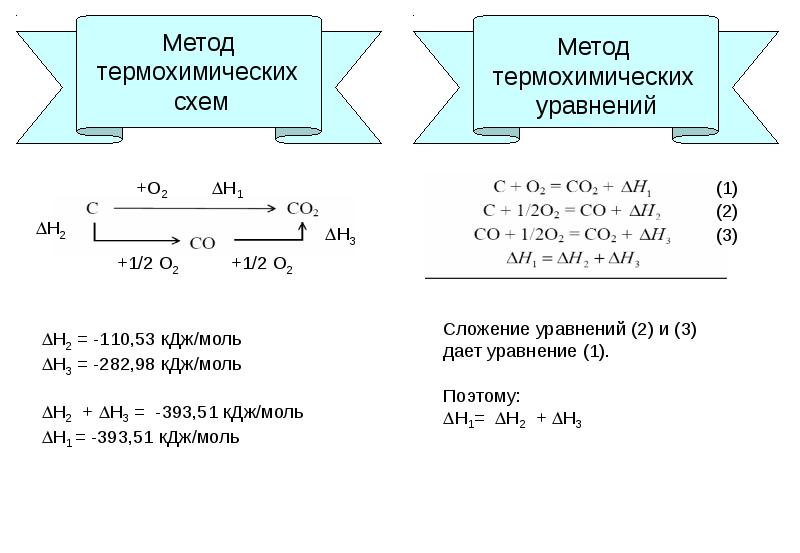
- 4. Метод термохимических схем
- 5. Следствия из закона Гесса.
- 7. Зависимость тепловых эффектов химических реакций от температуры. Теплоемкость. Уравнение Кирхгофа.
- 8. Расчеты тепловых эффектов реакций на основе следствий из закона Гесса с
- 9. Средние теплоемкости измеряются на определенном интервале температур Истинные теплоемкости соответствуют бесконечно
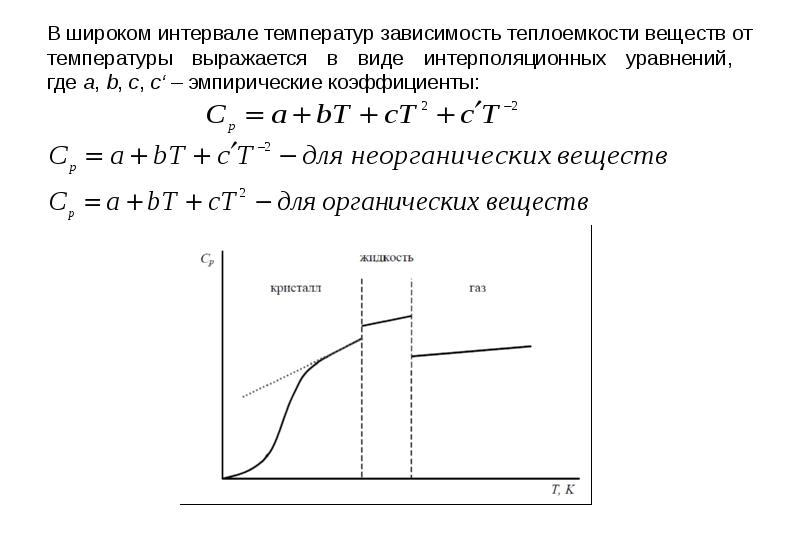
- 10. В широком интервале температур зависимость теплоемкости веществ от температуры выражается в
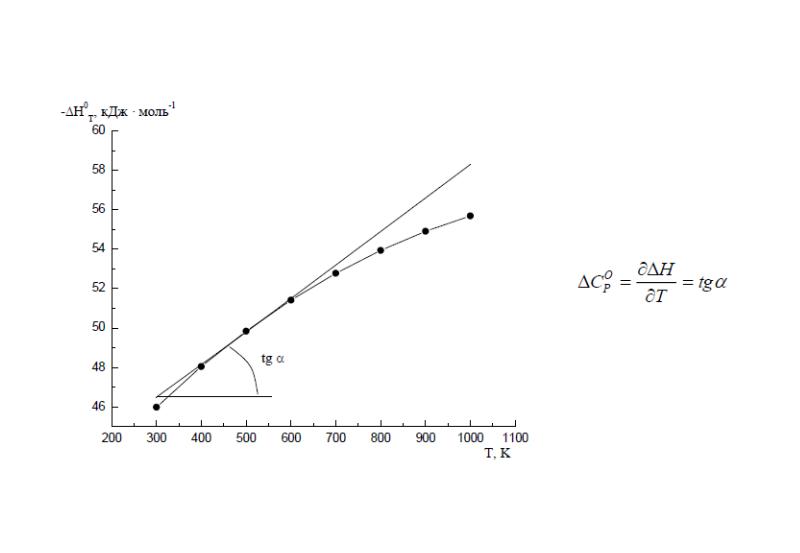
- 11. Уравнение Кирхгофа и его интегрирование
- 12. На практике интегрирование обычно проводят от стандартной температуры 298 К до
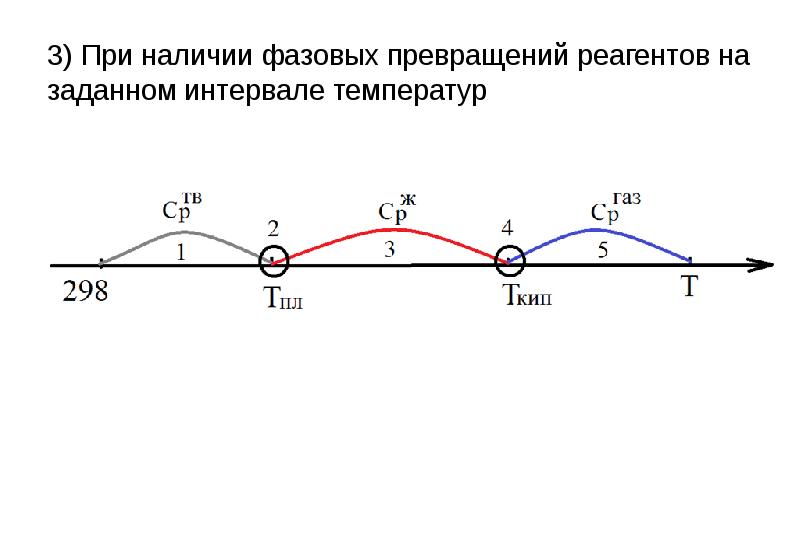
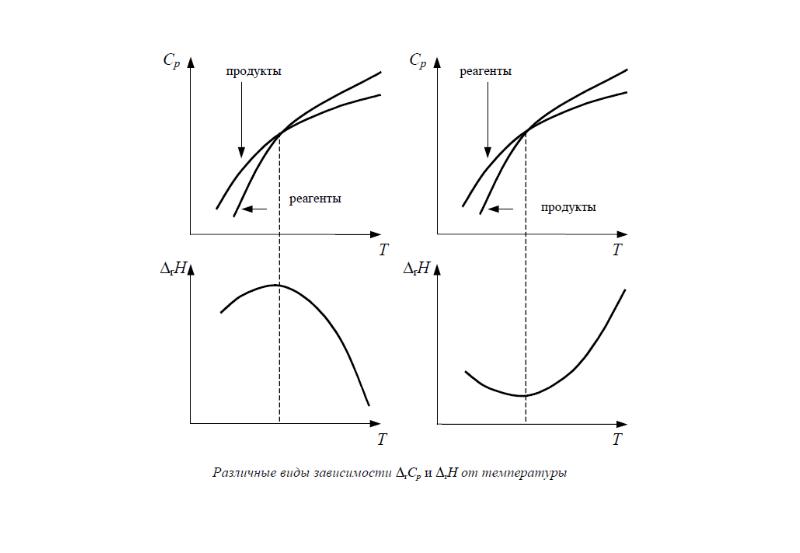
- 17. 3) При наличии фазовых превращений реагентов на заданном интервале температур
- 18. Процессы: изобарное нагревание твердого вещества от 298К до ТПЛ плавление твердого
- 19. МВЗ № 4 , гл. «Первое начало термодинамики»
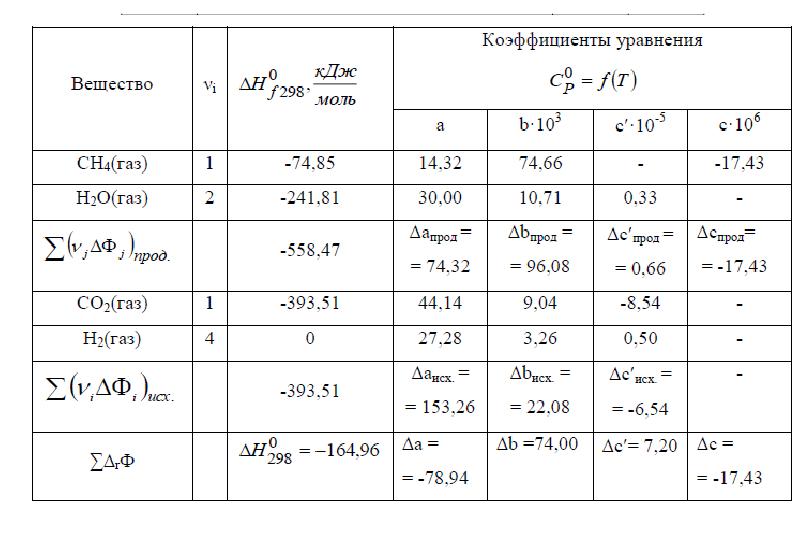
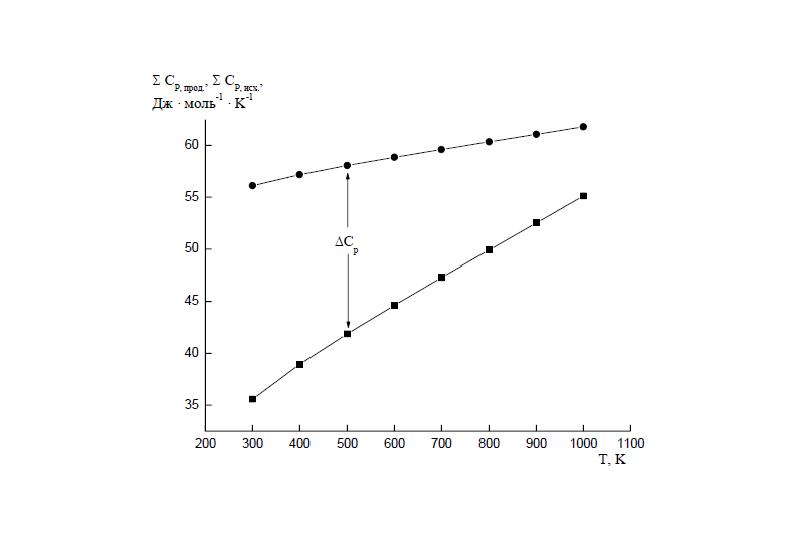
- 22. В задаче рассматриваются три метода расчета изменения теплоемкости в химической реакции
- 28. Скачать презентацию










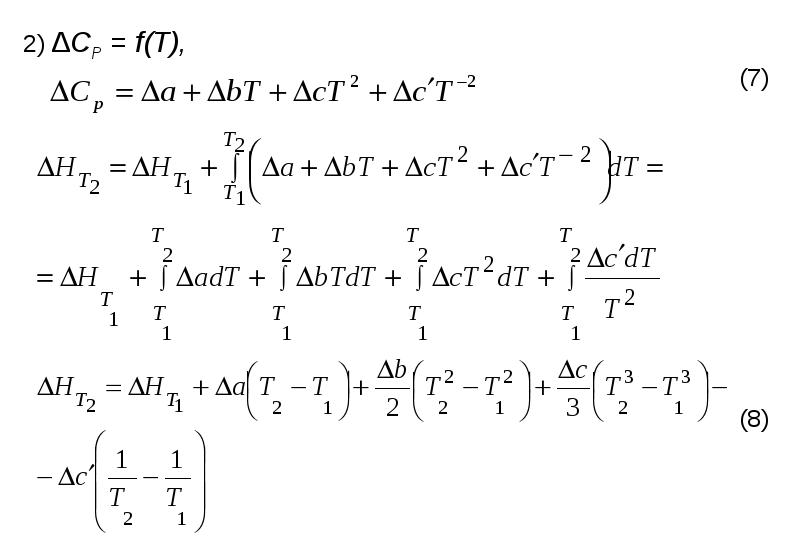
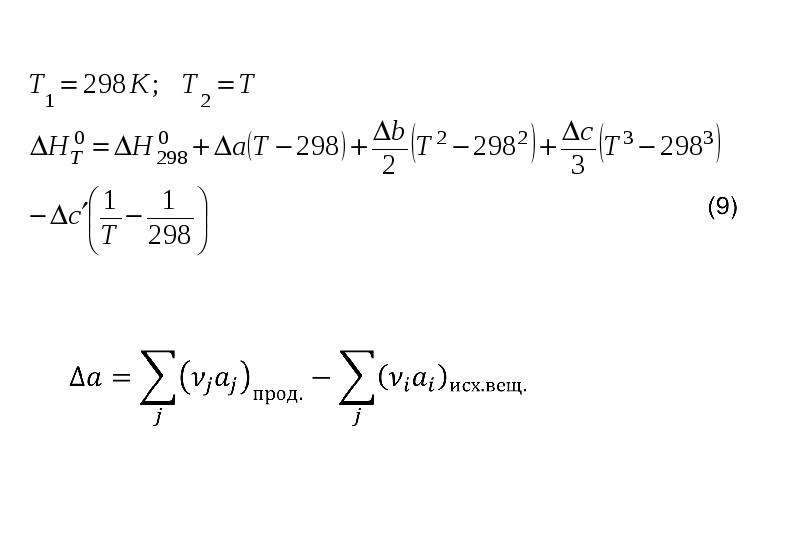
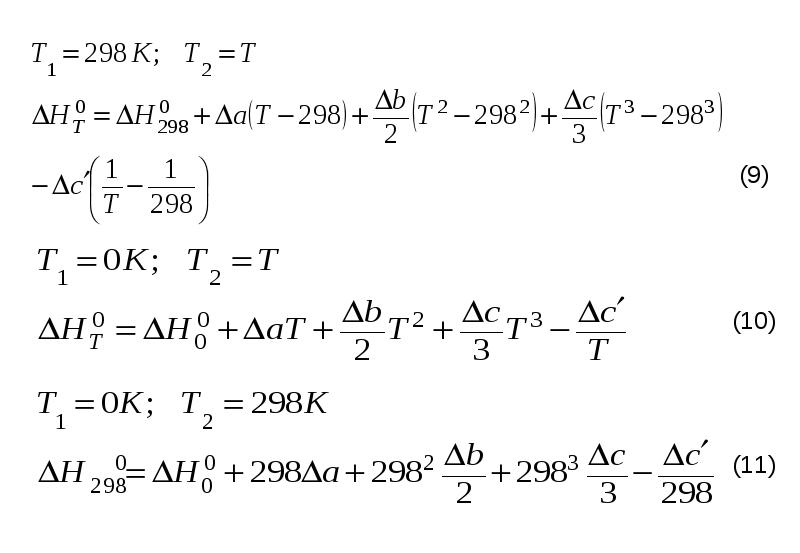







Слайды и текст этой презентации
Скачать презентацию на тему Термохимия. Расчет тепловых эффектов химических реакций можно ниже:
Похожие презентации





























