Химия. Лекция №1. Элементы химической термодинамики и биоэнергетики презентация
Содержание
- 2. План лекции Понятие термодинамической системы. 1 начало термодинамики. Энтальпия. Закон
- 3. Термодинамика – это наука об энергии, ее свойствах и превращениях.
- 4. Основные понятия: Термодинамическая система – любой объект природы, состоящий из достаточно
- 5. Термодинамические системы (ТДС) подразделяются: По характеру обмена системы с окружающей средой
- 6. По агрегатному состоянию компонентов на: - гомогенные (однородные) – системы в
- 7. Для термодинамической системы характерен ряд свойств, совокупность которых называют состоянием системы.
- 8. Свойства системы могут быть охарактеризованы с помощью термодинамических переменных, которые называются
- 9. Система может переходить из одного состояния в другое, что называется процессом.
- 10. При переходе системы из одного состояния в другое происходит изменение параметров
- 11. Важнейшей функцией состояния системы является внутренняя энергия (Е).
- 12. Е = Е2 – Е1, где Е - изменение
- 13. I начало термодинамики Это есть обобщенный результат работы многих ученых:
- 14. Математическое выражение I начала термодинамики: Математическое выражение I начала термодинамики: Q
- 15. Применение I начала термодинамики Изохорный процесс – характеризуется постоянством объема системы,
- 16. Изобарный процесс – характеризуется постоянством давления системы, р – const. Изобарный
- 17. Энтальпия – функция состояния, которая показывает энергию расширенной системы или теплосодержание
- 18. Закон Гесса Тепловой эффект реакции при постоянном объеме и давлении
- 19. Тепловой эффект реакции определяют двумя путями: Тепловой эффект реакции определяют
- 20. Первое следствие закона Гесса – тепловой эффект химической реакции равен разности
- 21. Второе следствие закона Гесса – тепловой эффект химической реакции равен разности
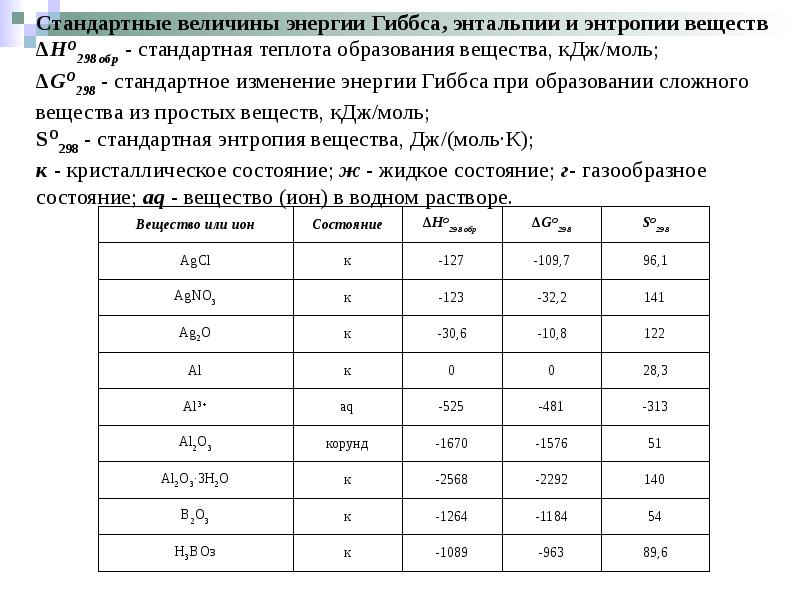
- 22. Стандартная теплота образования (∆Hо298 обр) – тепловой эффект преобразования из простых
- 24. Биоэнергетика. задача биоэнергетики - изучение законов и механизмов накопления,
- 25. Первое начало термодинамики для живых организмов все виды работ в организме
- 26. Потребность в калориях можно рассчитать индивидуально, если учитывать 3 основных признака:
- 27. Суточная потребность в калориях: Суточная потребность в калориях: для лиц умственного
- 28. Q=ΔЕ+W. Q=ΔЕ+W. Если в живом организме t°=37°С=const, то ΔЕ=0, тогда
- 29. Первичным источником энергии в организме для производства всех видов работ является
- 30. Второе начало термодинамики. Свободная энергия Гиббса. Первое начало термодинамики позволяет
- 31. Ответ на вопрос о направленности протекания реакции дает второе начало, оно
- 32. Формулировки второго начала термодинамики: Формулировки второго начала термодинамики: Клаузиус (1850): Теплота
- 33. Величина изменения энтропии для обратимых и не обратимых процессов в изолированных
- 34. Только часть теплоты идет на совершение работы, а другая часть является
- 35. Термодинамическая вероятность показывает число микросостояний, отвечающих данному макросостоянию системы. К макросостояниям
- 36. Энтропия увеличивается с увеличением температуры, при переходе из кристаллического состояния в
- 37. Изменение энтропии в реакции можно рассчитать, используя 1 следствие закона Гесса:
- 38. Применение II начала термодинамики к живым организмам Теорема Пригожина: в открытой
- 39. Истинным критерием направленности процессов является термодинамическая величина – свободная энергия Гиббса
- 40. Процессы, идущие в живых организмах называются: Процессы, идущие в живых организмах
- 41. Говоря об энергетике биохимических процессов, следует отметить их высокий КПД –
- 42. Скачать презентацию








































Слайды и текст этой презентации
Скачать презентацию на тему Химия. Лекция №1. Элементы химической термодинамики и биоэнергетики можно ниже:
Похожие презентации





























