Бензол молекуласында байланыстардың түзілу сызбанұсқасы презентация
Содержание
- 3. Ашылу тарихы Бензолды алғаш алған неміс химигі Иоганн Глаубер. Ол 1649
- 4. Екінші рет ашылуы Бензолды 1825 ж. М.Фарадей жарық газын зерттей
- 5. Жаңадан алынуы Неміс физико-химигі Эйльгард Митчерлих 1834 ж. бензой қышқылын
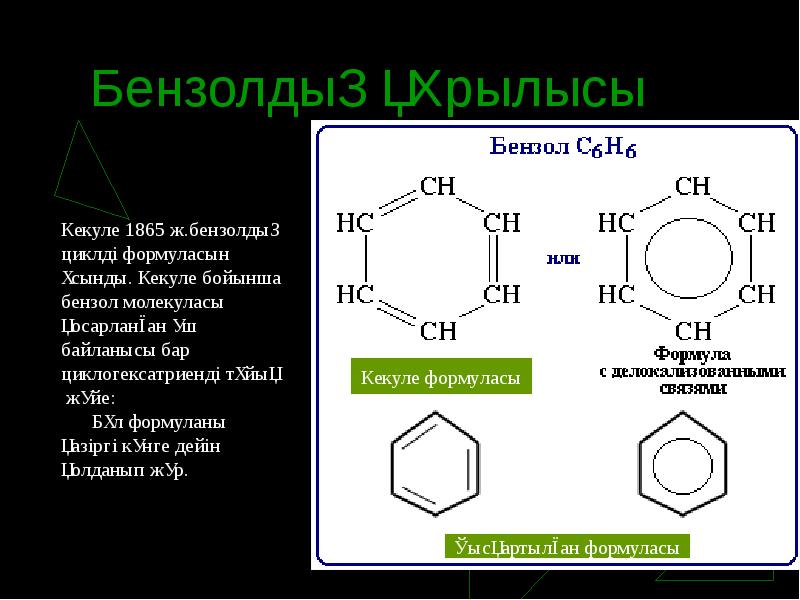
- 6. Бензолдың құрылысы
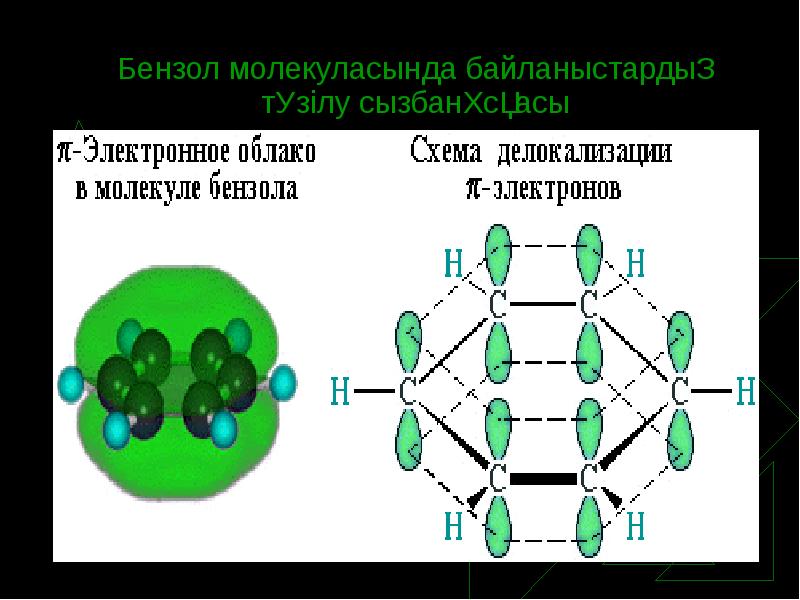
- 7. Бензол молекуласында байланыстардың түзілу сызбанұсқасы
- 8. Квантомеханикалық теория және бензол молекуласы Неміс химигі Э. Хюккель ароматтық қосылыстарға
- 9. Физикалық қасиеттері Бензолдың гомлогтық қатарының төменгі өкілдері, негізінен сұйықтық болады.Оның молекулалық
- 10. Химиялық қасиеттері 1.Бензолдың жануы: 2С6Н6 + 15О2 = 12СО2 + 6Н2О
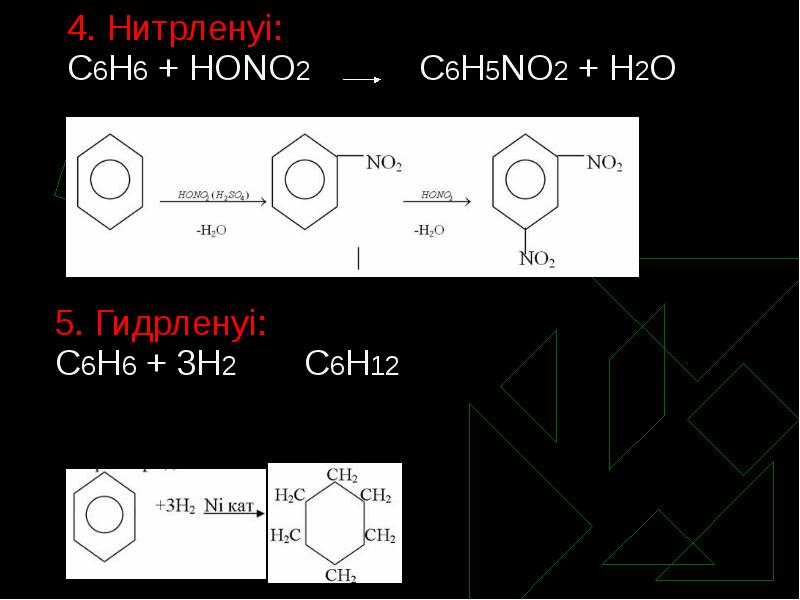
- 11. 4. Нитрленуі: 4. Нитрленуі: С6Н6 + НОNО2 С6Н5NО2 +
- 12. Алынуы Бензолды тас көмір шайырын айдап алады Қазіргі уақытта бензолды мұнайдан
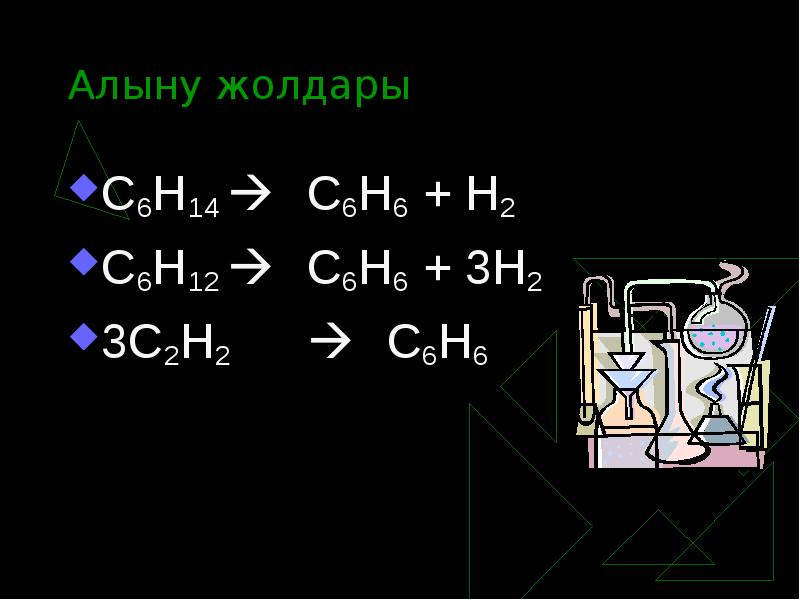
- 13. Алыну жолдары С6Н14 С6Н6 + Н2 С6Н12 С6Н6 + 3Н2 3С2Н2 С6Н6
- 14. Табиғи шикізаттары: Табиғи және серік газдар Мұнай Тас көмір
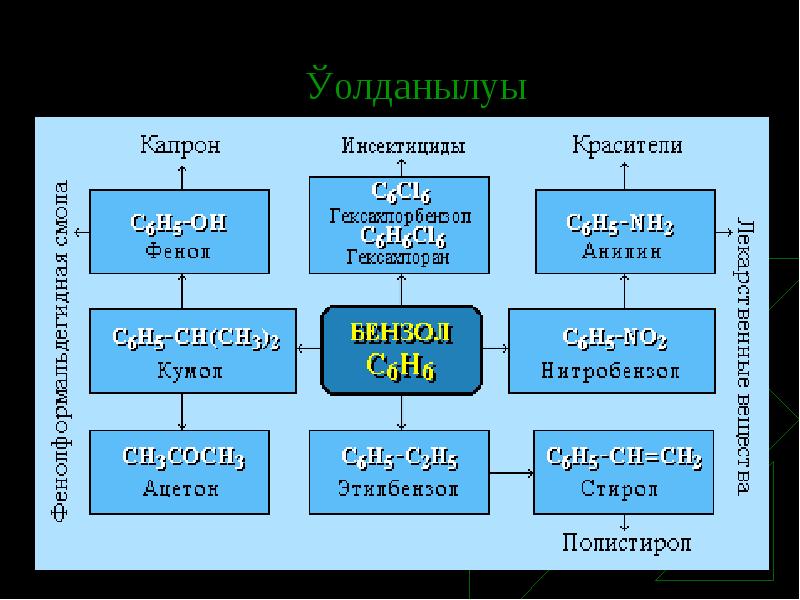
- 15. Қолданылуы
- 16. Скачать презентацию










Слайды и текст этой презентации
Скачать презентацию на тему Бензол молекуласында байланыстардың түзілу сызбанұсқасы можно ниже:
Похожие презентации





























