Фізичні та хімічні властивості кислот (урок хімії у 8 класі) презентация
Содержание
- 2. “Хто швидше” Скласти формули кислот із запропонованих символів
- 3. Відповіді до вправи “Хто швидше” НСl, Н2S04, НN03, Н2С03, Н2S, Н3Р04,
- 4. Хімічний диктант 1.HF
- 5. Л.Керрол «Аліса в країні чудес» « За кілька кроків від неї
- 6. Що спільного між ними?
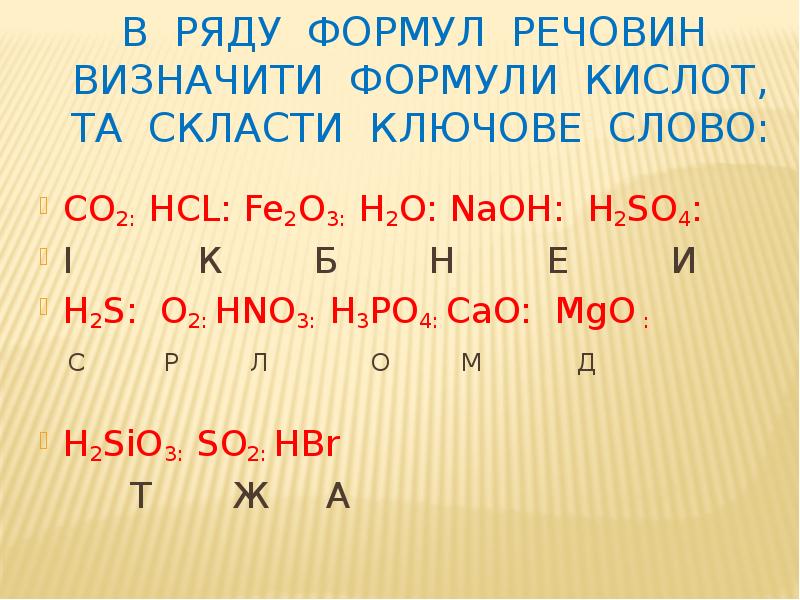
- 7. В ряду формул речовин визначити формули кислот, та скласти ключове слово:
- 8. Це цікаво знати: Сульфідна кислота H2S є у вулканічних газах і
- 9. Гра – естафета “Відгадай мене” 1. Які кислоти широко використовуються в
- 10. Фізичні властивості кислот а) за агрегатним станом: тверді H3PO4 ,
- 11. б) за розчинністю у воді неле ткі H2SO4 H2S
- 12. Кросворд
- 13. Пам’ятка Будьте максимально обережні, виконуючи роботу. Виконуйте лише ті досліди, які
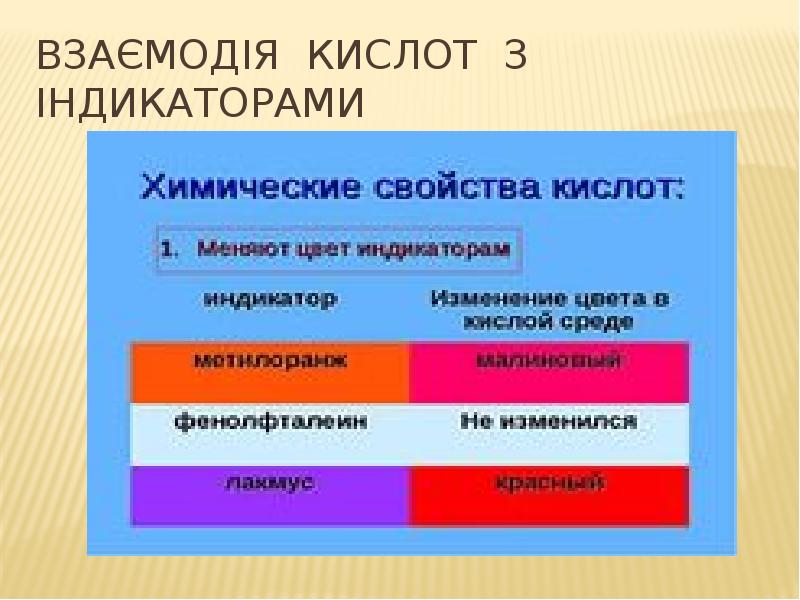
- 14. Взаємодія кислот з індикаторами
- 15. індикатори в рослинному світі
- 16. Здоров’язбережувальна хвилинка. Як за допомогою індикаторного папірця визначити, чи свіже м'ясо?
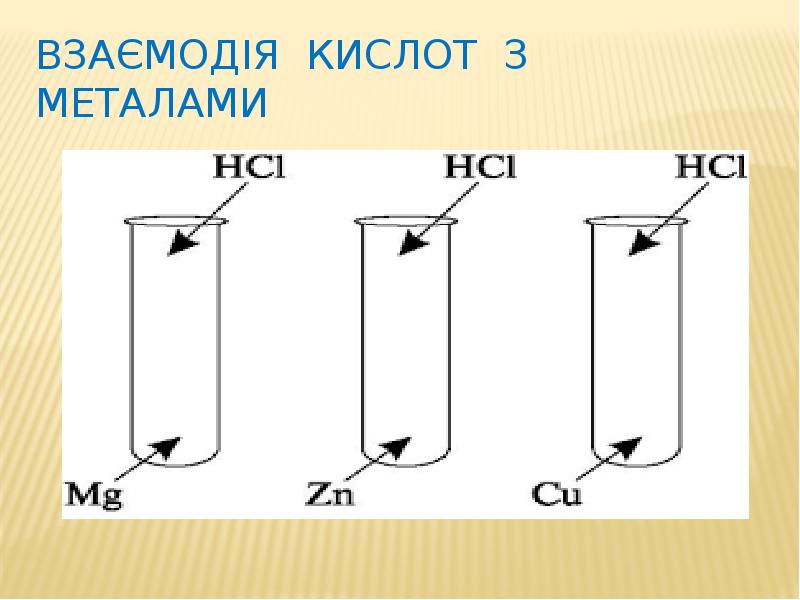
- 17. Взаємодія кислот з металами
- 18. Витискувальний ряд металів
- 19. Взаємодія кислот з оксидами металів
- 20. Задача До 160 грам купрум (ІІ) оксиду додали хлоридну кислоту. Яка
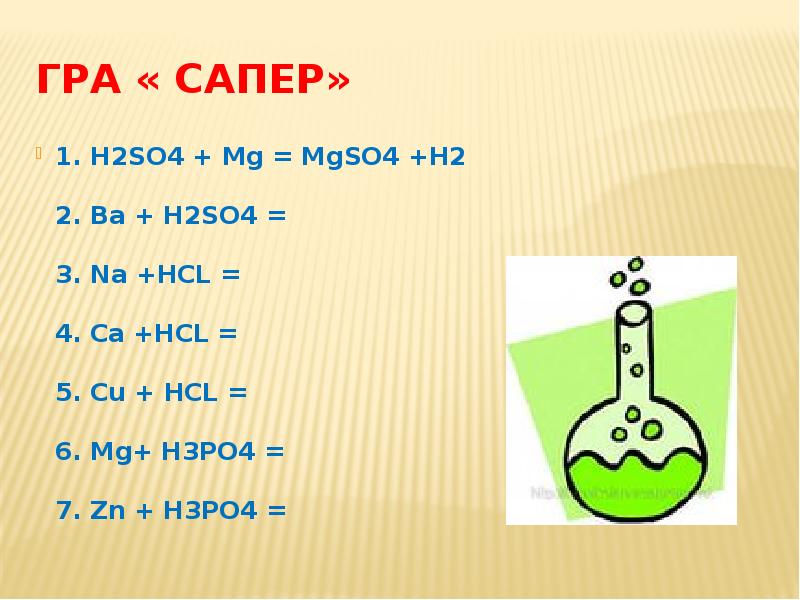
- 21. Гра « Сапер» 1. Н2SO4 + Mg = MgSO4 +H2 2.
- 22. Домашнє завдання. Опрацювати параграф 8 (ІІ), 9. Сторінка 61 вправа
- 23. Скачать презентацию


















Слайды и текст этой презентации
Скачать презентацию на тему Фізичні та хімічні властивості кислот (урок хімії у 8 класі) можно ниже:
Похожие презентации





























