Химические свойства бензола. Получение, применение
Содержание
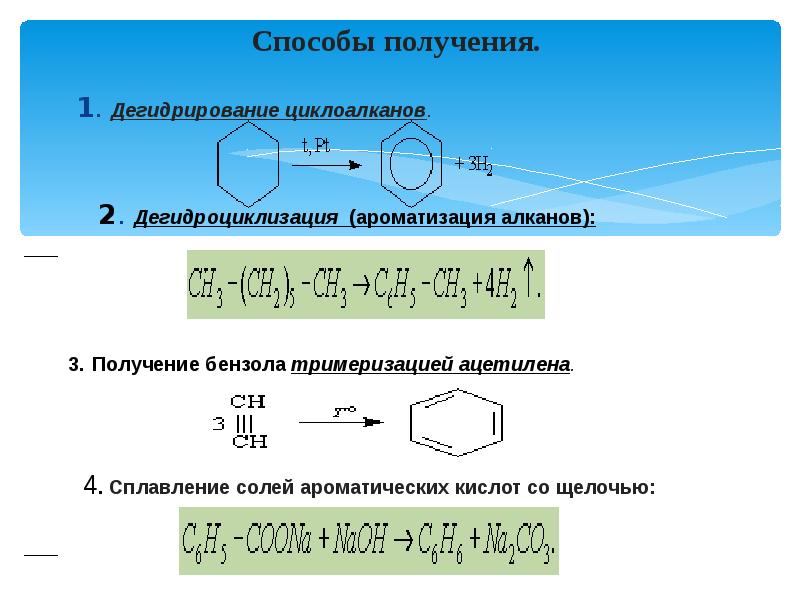
- 2. Способы получения. 1. Дегидрирование циклоалканов. 2. Дегидроциклизация
- 3. Химические свойства Обладая подвижной шестеркой p
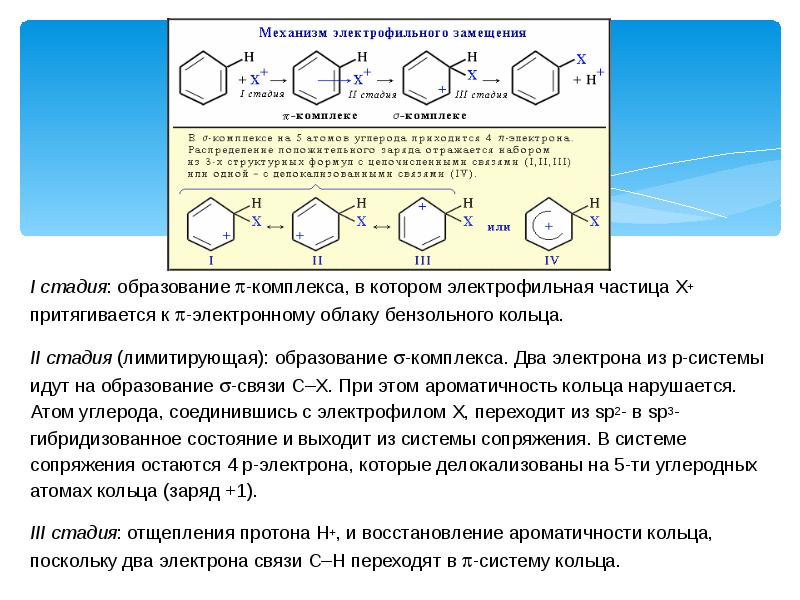
- 4. I стадия: образование -комплекса, в котором электрофильная частица Х+ притягивается к
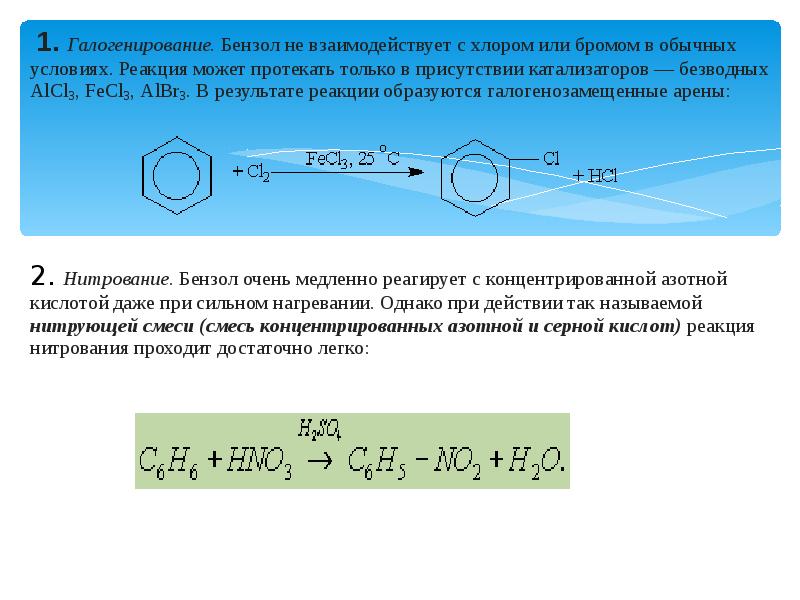
- 5. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных
- 6. 3. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное
- 7. 4.Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола
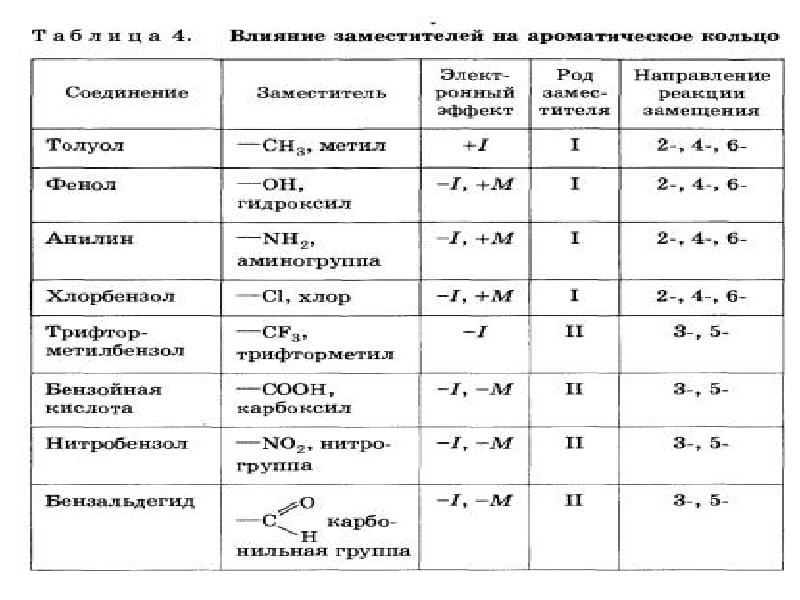
- 8. Правила ориентации (замещения) в бензольном кольце. Важнейшим фактором, определяющим химические свойства
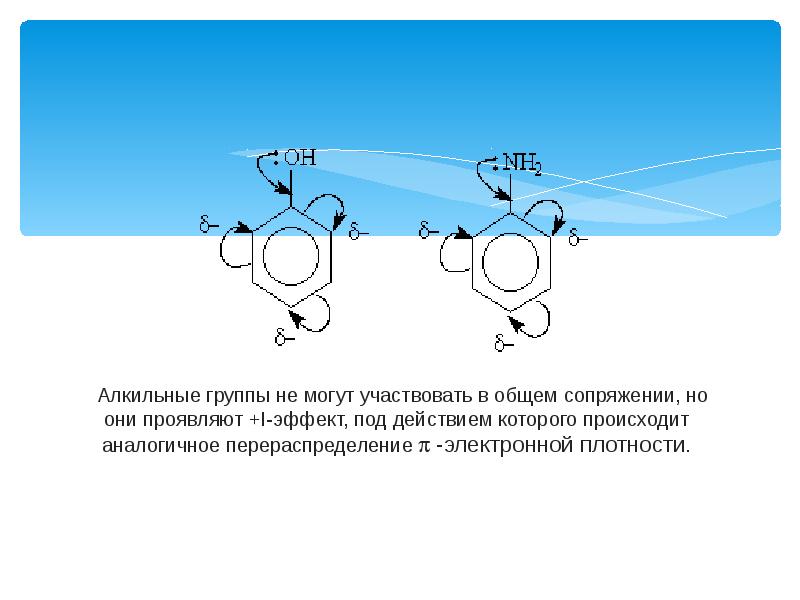
- 9. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта
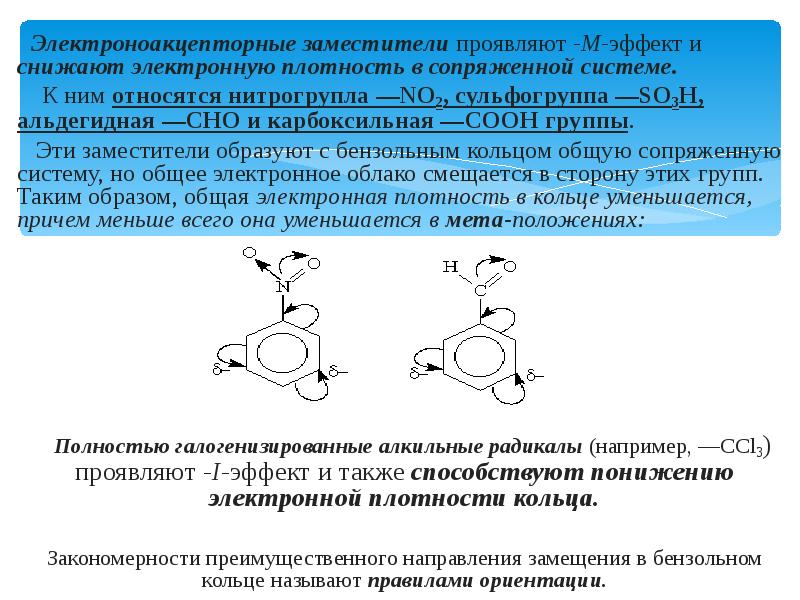
- 11. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе.
- 12. Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и
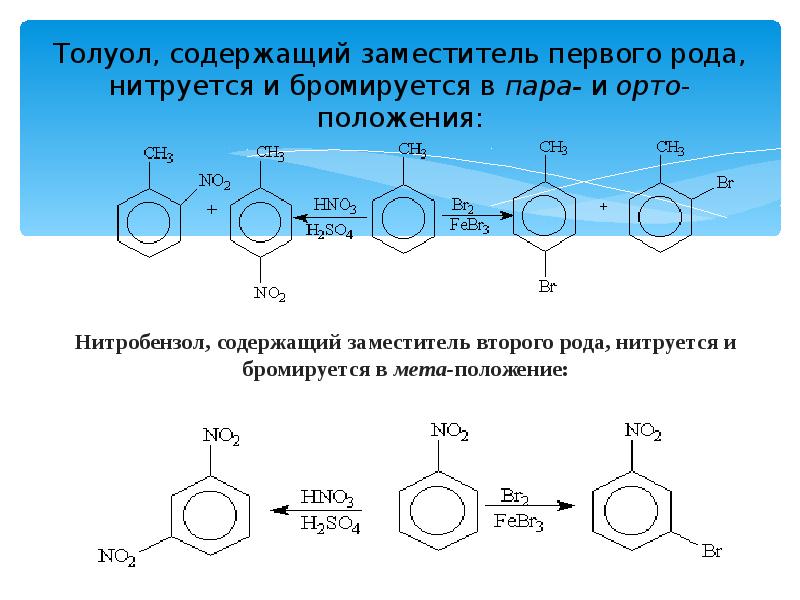
- 13. Толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и
- 15. Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют
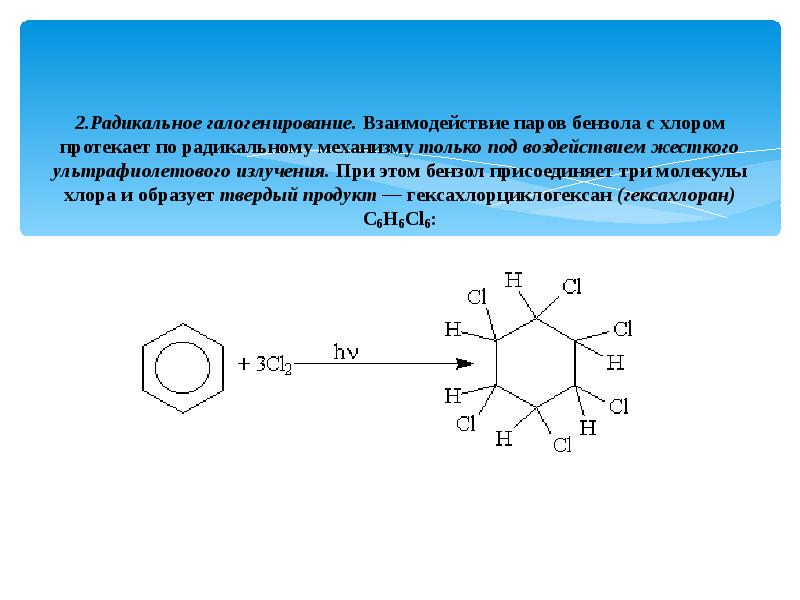
- 16. 2.Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму
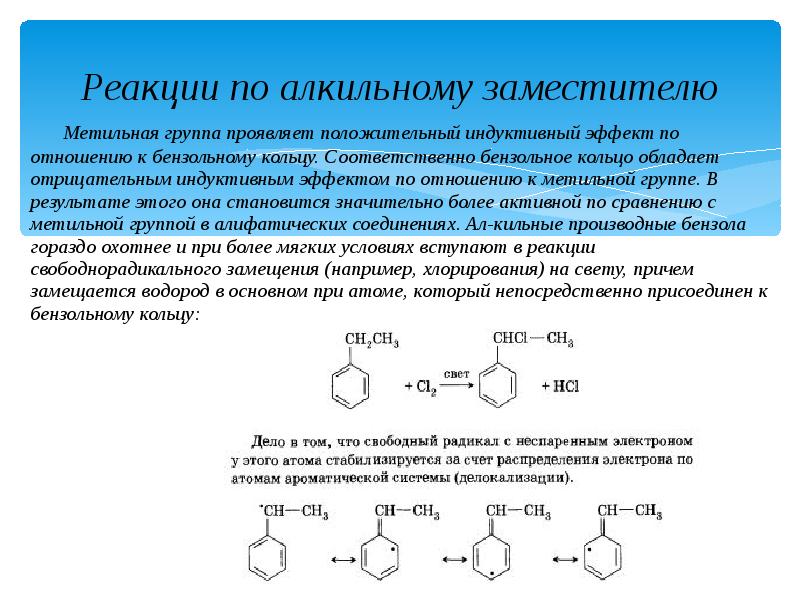
- 17. Реакции по алкильному заместителю Метильная группа проявляет положительный индуктивный эффект
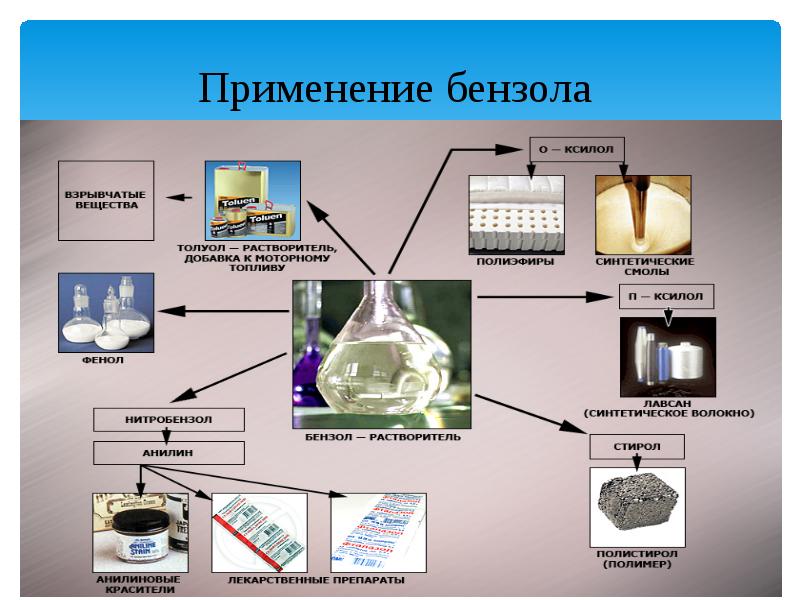
- 18. Применение бензола
- 19. Скачать презентацию








Слайды и текст этой презентации
Презентация на тему Химические свойства бензола. Получение, применение доступна для скачивания ниже:
Похожие презентации





























