Химический элемент - водород
Содержание
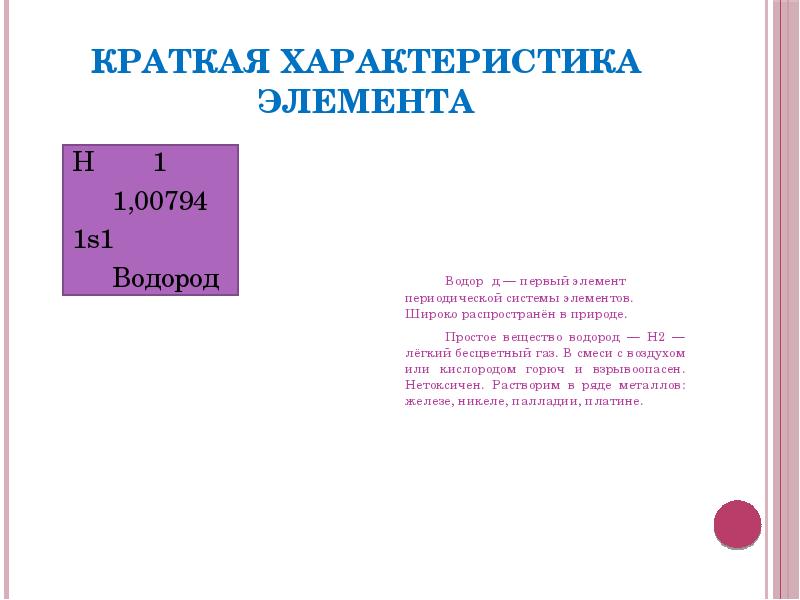
- 2. Краткая характеристика элемента H 1 1,00794 1s1 Водород
- 3. Происхождение названия Лавуазье дал водороду название hydrogène (от др.-греч. ὕδωρ —
- 4. Распространенность Водород — самый распространённый элемент во Вселенной. На его долю
- 5. Химические свойства Молекулы водорода Н2 довольно прочны, и для того, чтобы
- 6. Записанное уравнение отражает восстановительные свойства водорода. Записанное уравнение отражает восстановительные свойства
- 7. Взаимодействие со щелочными и щёлочноземельными металлами Взаимодействие со щелочными и щёлочноземельными
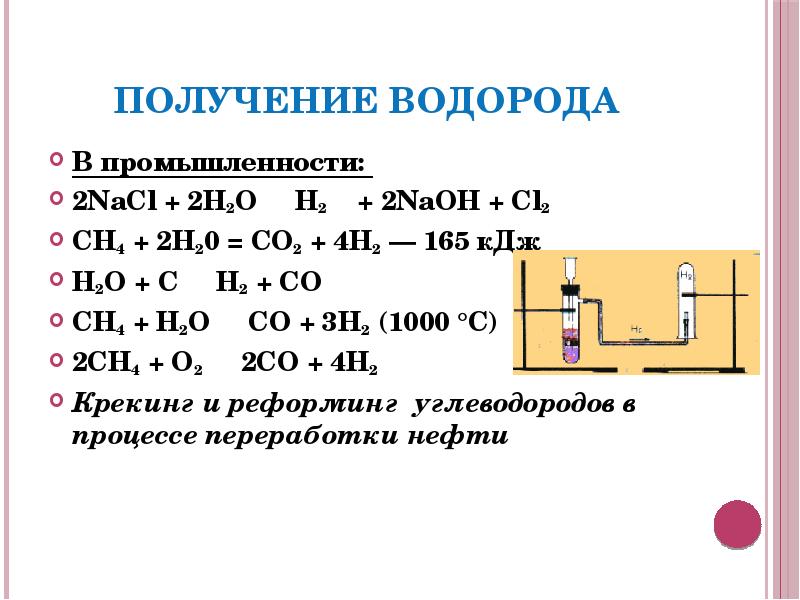
- 8. Получение водорода В промышленности: 2NaCl + 2H2O → H2↑ +
- 9. В лаборатории: Zn + 2HCl → ZnCl2 + H2↑ Ca
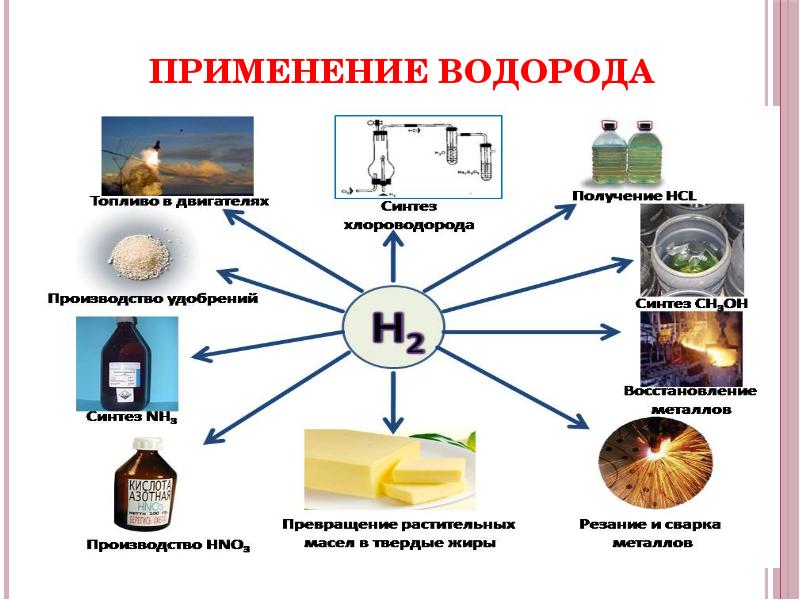
- 10. Применение водорода
- 11. Домашнее задание: § 17
- 12. Скачать презентацию








Слайды и текст этой презентации
Презентация на тему Химический элемент - водород доступна для скачивания ниже:
Похожие презентации





























